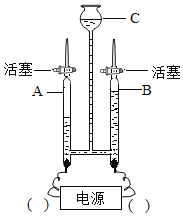
题目内容
【题目】有A、B、C、D四种元素,A是地壳中含量最丰富的元素;B的单质在A的单质中剧烈燃烧,发出明亮的蓝紫色火焰,生成有刺激性气味的气体E;D的原子核外有13个电子。根据以上条件回答:
(1)写出A、B的元素符号A:____B:______
(2)写出D元素的离子符号___气体E的化学式是____
(3)写出单质A和单质B反应生成E的文字表达式:____基本反应类型是____
【答案】O S Al3+ SO2 硫+氧气![]() 二氧化硫 化合反应
二氧化硫 化合反应
【解析】
A是地壳中含量最丰富的元素,地壳中含量最多的元素是氧元素,所以A是氧元素,B的单质在氧气中剧然燃烧,发出明亮的蓝紫色火焰,生成有刺激性气味的气体E,硫在氧气中燃烧发出明亮的蓝紫色火焰,生成二氧化硫,所以B是硫,E是二氧化硫,D的原子核外有13个电子,核外电子数等于原子序数,所以D是铝元素,经过验证,推导正确。
根据以上分析可知:
(1)所以A是:O,B是:S;
(2)铝元素在化学反应易失去3个电子形成稳定结构,其离子符号为Al3+;气体E是二氧化硫,化学式是SO2;
(3)硫和氧气在点燃的条件下生成二氧化硫,文字表达式为:硫+氧气![]() 二氧化硫 ;该反应是由两种物质生成一种物质的反应,基本反应类型是化合反应。
二氧化硫 ;该反应是由两种物质生成一种物质的反应,基本反应类型是化合反应。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
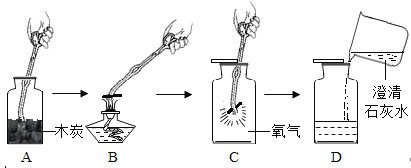
初中学业考试导与练系列答案【题目】某学习小组在做“寻找新的催化剂”课题时,发现将生锈的铁钉放到过氧化氢溶液中,也可以加快过氧化氢的分解速率。于是,他们对此展开探究:
(提出问题)什么物质是该反应的催化剂?
(猜想与假设)
假设一:小芳同学:铁钉表面的氧化铁是![]() 溶液分解反应的催化剂。
溶液分解反应的催化剂。
假设二:小华同学:铁钉里的铁是![]() 溶液分解反应的催化剂。
溶液分解反应的催化剂。
(实验与结论)
实验操作 | 实验现象 | 实验结论 |
实验Ⅰ:把一定质量的氧化铁粉末加入到装有 | ①________ | 假设一成立 |
实验Ⅱ:取 | 无现象 | 假设二③________(填“成立”或“不成立”) |
(反思与交流)(1)同学们讨论后认为,小芳的“实验Ⅰ”还不能确切说明氧化铁就是过氧化氢分解制取氧气的催化剂,理由是:④________;请你设计实验(写出实验操作、现象及结论)证明其中的某一点理由:⑤________。
(2)小强观察发现“实验Ⅱ”中一直没有现象的试管,过了一段时间后试管中也出现了气体,小强觉得奇怪。你猜想其中的原因是:⑥________。
(拓展提升)贝壳的主要成分是碳酸钙![]() ,请回答以下问题:
,请回答以下问题:
(1)碳酸钙中碳、氧两种元素的质量比为________。
(2)若实验测得某贝壳中碳酸钙的质量分数为![]() ,则
,则![]() 该贝壳中含有的钙元素质量相当于多少
该贝壳中含有的钙元素质量相当于多少![]() 生石灰
生石灰![]() 中含有的钙元素的质量。(写出计算过程)_______g
中含有的钙元素的质量。(写出计算过程)_______g