题目内容
【题目】根据所给的仪器回答问题:
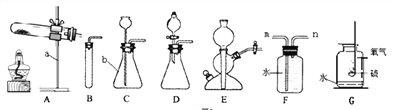
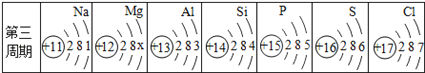
I.写出仪器名称,a___、b___;
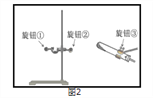
II.某同学用A装置制取氧气时发现试管位置太高,不能用外焰加热,该同学应调节图2中的旋钮___(填“①”或“②”或“③”).
利用改正后的A装置制取氧气,反应的化学方程式:
___,若用装置F收集并粗略测出收集O2体积,还需在___(填m或n)端接一个量筒以便测出排出的水的体积。G图是硫在氧气中燃烧的实验,观察到的现象是___,该反应的化学方程式是_______________________________________;
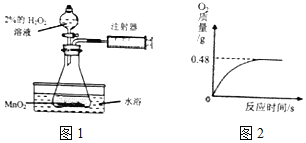
晓晓为了探究温度对H2O2分解速率的影响,利用如图所示装置(夹持装置略去)进行实验(水浴是利用热水进行加热),实验数据记录如表所示:
实验1 | 实验2 | |
MnO2的质量/克 | 0.5 | 0.5 |
2%的H2O2的体积/毫升 | 20 | X |
温度/℃ | 20 | 80 |
(1)实验2中X的值应为___毫升;
(2)实验中,可通过___来比较H2O2分解速率的大小;
(3)实验2中水浴温度控制在80℃时,测定的反应速率会比真实值偏大,其原因是___.
a、锥形瓶内气体受热膨胀 b、收集到的氧气中混有空气
c、温度较高时水蒸发成水蒸气 d、生成更多的氧气
(4)晓晓从家中拿来一瓶久置的医用过氧化氢溶液来测定该溶液中溶质质量分数.她取出该溶液51g,加入适量二氧化锰,生成O2的质量与反应时间的关系如图2所示.
Ⅰ、完全反应后生成氧气的质量为___moL.
Ⅱ、计算参与反应的过氧化氢的物质的量___.(写出计算过程)
Ⅲ、这瓶过氧化氢溶液的质量分数为___.
【答案】 铁架台 锥形瓶 2KClO3![]() 2KCl+3O2↑ m 产生蓝紫色火焰,有刺激性气味气体产生 S+O2
2KCl+3O2↑ m 产生蓝紫色火焰,有刺激性气味气体产生 S+O2![]() SO2 20 相同的时间内注射器内气体的体积 ac Ⅰ 0.015mol 0.03mol 2%
SO2 20 相同的时间内注射器内气体的体积 ac Ⅰ 0.015mol 0.03mol 2%
【解析】I.仪器名称,a:铁架台,b:锥形瓶;II.某同学用A装置制取氧气时发现试管位置太高,不能用外焰加热,该同学应调节图2中的旋钮②降低试管的高度;氯酸钾法制氧气可用此装置,氯酸钾在二氧化锰的作用下受热分解生成氯化钾和氧气,反应的化学方程式:2KClO3 ![]() 2KCl+3O2↑,若用装置F收集并粗略测出收集O2体积,由于氧气的密度比水的小,所以氧气从n端进入,所以还需在m端接一个量筒以便测出排出的水的体积。硫在氧气中燃烧的实验,观察到的现象是产生蓝紫色火焰,有刺激性气味气体产生,该反应的化学方程式是S+O2
2KCl+3O2↑,若用装置F收集并粗略测出收集O2体积,由于氧气的密度比水的小,所以氧气从n端进入,所以还需在m端接一个量筒以便测出排出的水的体积。硫在氧气中燃烧的实验,观察到的现象是产生蓝紫色火焰,有刺激性气味气体产生,该反应的化学方程式是S+O2![]() SO2; (1)据控制变量原则,实验2中X的值应为20毫升;(2)实验中,可通过相同的时间内注射器内气体的体积来比较H2O2分解速率的大小,气体越多,反应速率越快;(3)实验2中水浴温度控制在80℃时,测定的反应速率会比真实值偏大,其原因是锥形瓶内气体受热膨胀、温度较高时过氧化氢溶液中的水水蒸发成水蒸气,使得到的气体是氧气和水蒸气的总量而偏多;(4)Ⅰ、由图可知,完全反应后生成氧气的质量0.48g,物质的量为:0.48g ÷32g/moL= 0.015mol;Ⅱ、设参与反应的过氧化氢的物质的量为x
SO2; (1)据控制变量原则,实验2中X的值应为20毫升;(2)实验中,可通过相同的时间内注射器内气体的体积来比较H2O2分解速率的大小,气体越多,反应速率越快;(3)实验2中水浴温度控制在80℃时,测定的反应速率会比真实值偏大,其原因是锥形瓶内气体受热膨胀、温度较高时过氧化氢溶液中的水水蒸发成水蒸气,使得到的气体是氧气和水蒸气的总量而偏多;(4)Ⅰ、由图可知,完全反应后生成氧气的质量0.48g,物质的量为:0.48g ÷32g/moL= 0.015mol;Ⅱ、设参与反应的过氧化氢的物质的量为x
2H2O2 ![]() 2H2O+O2↑
2H2O+O2↑
2 1
X 0.015mol
2/x=1/ 0.015mol x= 0.03mol
Ⅲ、这瓶过氧化氢溶液的质量为0. 1.02g 03mol×34g/moL=1.02g
这瓶过氧化氢溶液的质量分数为:1.02g ÷51g×100%=2%
答:Ⅰ、完全反应后生成氧气的质量为0.015mol moL.
Ⅱ、计算参与反应的过氧化氢的物质的量0.03mol
Ⅲ、这瓶过氧化氢溶液的质量分数为2%

 口算题天天练系列答案
口算题天天练系列答案