题目内容
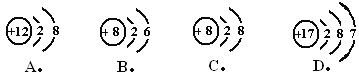
【题目】下图是第三周期部分元素的微粒结构示意图,请根据题目要求填空。
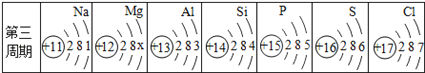
(1)上图中x=____________。
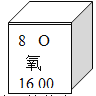
(2)硫原子的质子数为____________,铝原子的最外层电子数为____________。
(3)某粒子的结构示意图为![]() ,当a-b=8时,该粒子的符号为____________。
,当a-b=8时,该粒子的符号为____________。
【答案】 2 16 3 S2-
【解析】(1)原子结构示意图中核内质子数等于核外电子数,故x=2;(2)由图可知,硫原子的质子数是16,;铝原子的最外层电子数为3;(3)如果该示意图为原子结构示意图的话,a-b=10,而题中告诉a-b=8,说明该示意图中得到了2个单位的电子,形成了8电子稳定结构,所以该示意图是硫离子的结构示意图,符号为S2-。

 阅读快车系列答案
阅读快车系列答案【题目】二百多年前,法国化学家拉瓦锡用定量的方法研究了空气的成分。仿照这个历史上著名实验的原理,我们可以用图1所示装置来测定空气中氧气的含量。

【提出问题】用红磷燃烧的方法为什么测出的氧气含量远低于21%?
【分析讨论】(1)实验装置漏气;(2)________________,导致装置内氧气有剩余;(3)……
【实验与交流】在老师的指导下,同学们查阅了白磷、红磷等物质燃烧需要的最低含氧量如下:
资料1:
可燃物名称 | 红磷 | 白磷 | 蜡烛 |
最低含氧量/% | 8.0 | 4.0 | 16.0 |
甲、乙、丙三个小组分别用上述过量红磷、白磷、蜡烛三种物质进行该实验,用测氧气浓度的传感器测得反应后的氧气浓度分别为8.85%、3.21%、16.7%,数据与表中的理论值基本一致。其中蜡烛燃烧后用测一氧化碳浓度传感器测算一氧化碳浓度约为2%。
资料2:蜡烛或者木炭在密闭的集气瓶中燃烧,氧气浓度会不断变小,会有一氧化碳气体生成。常温下一氧化碳难溶于水,且不与澄清石灰水反应。根据以上信息回答下列问题:
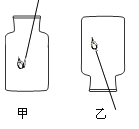
(1)白磷和红磷相比,使用白磷能使结果更准确,其原因是_______________________。
(2)请写出红磷燃烧的化学方程式______________,该反应属于___________反应(填一种基本反应类型);有同学提议选用木炭替代红磷做实验,在集气瓶底部预先放少量澄清石灰水吸收生成的二氧化碳气体,小华觉得不可行,其主要原因是________________。
(3)兴趣小组用白磷代替红磷进行实验,已知化学反应前后元素种类和质量都不发生改变,若该实验中消耗的氧气质量为0.8克,则理论上生成的五氧化二磷的质量为______。
【实验拓展】某校研究性学习小组用下图装置进行镁条在空气中燃烧的实验。燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶体积的70%。
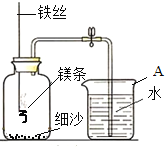
(4)实验过程中,若弹簧夹未夹紧,则进入集气瓶中的水会_______(选填“偏大”、“偏小”或“不变”)。
(5)如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的_______,现进入集气瓶中水的体积约为其容积的 70%,根据空气的组成可推出减少的气体中还一定有氮气,其理由是______________________。
【提出问题】氮气是怎样减少的呢?
【作出假设】氮气是与镁条反应而减少的。
【查阅资料】
①镁条在空气中燃烧时,不仅与空气中的氧气反应生成氧化镁,还能与氮气反应生成氮化镁(氮化镁中氮元素的化合价为-3价),请写出镁条与氮气反应的化学方程式__________;
②镁条除了能与氮气反应,还可以在二氧化碳气体中燃烧生成碳和氧化镁,请你写出该反应的化学方程式___________
【验证实验】用坩埚钳夹持镁条,点燃后迅速伸入盛有氮气的集气瓶中,镁条燃烧,发出暗红色火焰,生成淡黄色粉末,并放出大量的热。
【得出结论】镁条能在氮气中燃烧生成固体氮化镁。
【实验反思】通过以上实验探究,我们可以知道用于测定空气中氧气含量所选用的药品,应符合的条件是____________________。
【题目】若将一定量的某中电池燃料R和氧气置于封闭的容器中,在一定条件下充分反应,测定反应前后各物质的质量如下表,不正确的是( )
物质 | R | 氧气 | 水 | 二氧化碳 |
反应前质量 | 8.0 | 9.6 | 0 | 0 |
反应后质量 | 待测 | 0 | 7.2 | 8.8 |
A. 表中待测的值为1.6 B. 物质中含有碳氢氧三种元素
C. 物质中碳氢质量比为3:1 D. 二氧化碳和水的分子个数比为1:3
【题目】下列现象不能用质量守恒定律解释的是 ( )
A. 蜡烛燃烧时慢慢变短 B. 打开盛酒精的瓶盖,一段时间后酒精的质量变小
C. 镁带燃烧后,固体的质量增加 D. 澄清石灰水在空气中露置一段时间后变重
【题目】根据所给的仪器回答问题:
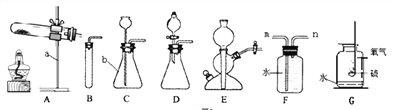
I.写出仪器名称,a___、b___;
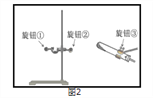
II.某同学用A装置制取氧气时发现试管位置太高,不能用外焰加热,该同学应调节图2中的旋钮___(填“①”或“②”或“③”).
利用改正后的A装置制取氧气,反应的化学方程式:
___,若用装置F收集并粗略测出收集O2体积,还需在___(填m或n)端接一个量筒以便测出排出的水的体积。G图是硫在氧气中燃烧的实验,观察到的现象是___,该反应的化学方程式是_______________________________________;
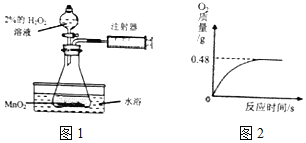
晓晓为了探究温度对H2O2分解速率的影响,利用如图所示装置(夹持装置略去)进行实验(水浴是利用热水进行加热),实验数据记录如表所示:
实验1 | 实验2 | |
MnO2的质量/克 | 0.5 | 0.5 |
2%的H2O2的体积/毫升 | 20 | X |
温度/℃ | 20 | 80 |
(1)实验2中X的值应为___毫升;
(2)实验中,可通过___来比较H2O2分解速率的大小;
(3)实验2中水浴温度控制在80℃时,测定的反应速率会比真实值偏大,其原因是___.
a、锥形瓶内气体受热膨胀 b、收集到的氧气中混有空气
c、温度较高时水蒸发成水蒸气 d、生成更多的氧气
(4)晓晓从家中拿来一瓶久置的医用过氧化氢溶液来测定该溶液中溶质质量分数.她取出该溶液51g,加入适量二氧化锰,生成O2的质量与反应时间的关系如图2所示.
Ⅰ、完全反应后生成氧气的质量为___moL.
Ⅱ、计算参与反应的过氧化氢的物质的量___.(写出计算过程)
Ⅲ、这瓶过氧化氢溶液的质量分数为___.