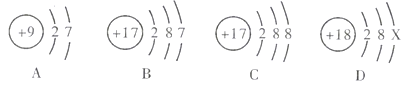题目内容
【题目】以下是从元素周期表中截取的四种元素的信息,请回答下列问题:
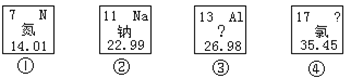
(1)①元素原子的相对原子质量是_______;③元素原子的核外电子数是_______。
(2)②元素的一种微粒的结构示意图为![]() ,它属于 ________(填“金属元素”或“非金属元素”或“稀有气体元素”),该微粒的符号为______,其化学性质_________(填“稳定”或“不稳定”)。
,它属于 ________(填“金属元素”或“非金属元素”或“稀有气体元素”),该微粒的符号为______,其化学性质_________(填“稳定”或“不稳定”)。
(3)由②与④形成化合物的化学式是_________。
【答案】 14.01 13 金属元素 Na+ 稳定 NaCl
【解析】(1)根据元素周期表中的一个小格所提供的信息,可查得①元素原子的相对原子质量是 14.01;根据元素周期表中的一个小格所提供的信息可知③元素是铝属于金属元素,元素的原子序数=质子数=核电荷数,结构示意图中元素的质子数为 13;(2)根据元素周期表中的一个小格所提供的信息可知②元素是钠属于金属元素,元素的原子序数=质子数=核电荷数,结构示意图中元素的质子数为 11,核电荷数为10,说明该元素失去1个电子,该微粒的符号为Na+ ;(3)②与④元素分别是Na和Cl,形成化合物的化学式是NaCl。

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案【题目】根据所给的仪器回答问题:
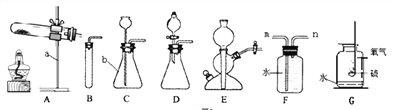
I.写出仪器名称,a___、b___;
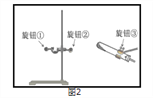
II.某同学用A装置制取氧气时发现试管位置太高,不能用外焰加热,该同学应调节图2中的旋钮___(填“①”或“②”或“③”).
利用改正后的A装置制取氧气,反应的化学方程式:
___,若用装置F收集并粗略测出收集O2体积,还需在___(填m或n)端接一个量筒以便测出排出的水的体积。G图是硫在氧气中燃烧的实验,观察到的现象是___,该反应的化学方程式是_______________________________________;
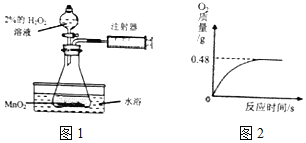
晓晓为了探究温度对H2O2分解速率的影响,利用如图所示装置(夹持装置略去)进行实验(水浴是利用热水进行加热),实验数据记录如表所示:
实验1 | 实验2 | |
MnO2的质量/克 | 0.5 | 0.5 |
2%的H2O2的体积/毫升 | 20 | X |
温度/℃ | 20 | 80 |
(1)实验2中X的值应为___毫升;
(2)实验中,可通过___来比较H2O2分解速率的大小;
(3)实验2中水浴温度控制在80℃时,测定的反应速率会比真实值偏大,其原因是___.
a、锥形瓶内气体受热膨胀 b、收集到的氧气中混有空气
c、温度较高时水蒸发成水蒸气 d、生成更多的氧气
(4)晓晓从家中拿来一瓶久置的医用过氧化氢溶液来测定该溶液中溶质质量分数.她取出该溶液51g,加入适量二氧化锰,生成O2的质量与反应时间的关系如图2所示.
Ⅰ、完全反应后生成氧气的质量为___moL.
Ⅱ、计算参与反应的过氧化氢的物质的量___.(写出计算过程)
Ⅲ、这瓶过氧化氢溶液的质量分数为___.
【题目】空气中氧气含量测定的再认识
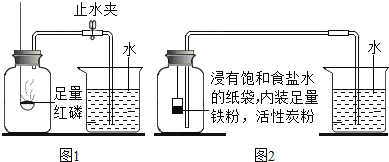
【实验回顾】如图是实验室用红磷燃烧来粗略测定空气中氧气含量的装置。
(1)写出红磷燃烧的符号表达式: ____________________。
(2)实验原理:由于红磷燃烧消耗空气中的氧气,使瓶内减小,烧杯中水倒吸到集气瓶。若装置的气密性良好,操作规范,用量筒测量进入瓶中水的体积,能粗略测得空气中氧气的含量。
【问题提出】有实验资料表明:燃烧过程中当氧气体积分数低于7%时,红磷就无法继续燃烧,因此通过上述实验,测量结果与理论值误差较大。
【实验改进】
Ⅰ.根据铁在空气中生锈的原理设计图2实验装置,再次测定空气中氧气含量。装置中饱和食盐水、活性炭会加速铁生锈。
Ⅱ.测得实验数据如表
【交流表达】
(1)铁生锈过程发生复杂的化学反应,首先是铁与氧气、水反应生成氢氧化亚铁,写出该反应的符号表达式:__________________________。
(2)根据如表数据计算,改进实验后测得的空气中氧气的体积分数是_______。(计算结果精确到0.1%)
测量项目 | 实验前 | 实验后 | |
烧杯中水的体积 | 烧杯中剩余水的体积 | 集气瓶(扣除内容物)和导管的容积 | |
体积/mL | 80.0 | 54.5 | 126.0 |
(3)从实验原理角度分析,改进后的实验结果比前者准确度更高的原因是:
①_____________________;②______________________。