题目内容
【题目】氧化锌(ZnO)可用于湿疹、癣等皮肤病的治疗。其种生产工艺流程如下:
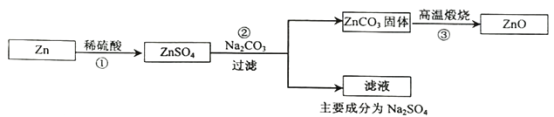
(1)反应③的化学方程式为______。
(2)滤液中的阴离子除SO42-外,还可能含有______。
(3)加热分解Zn(NO3)2也可以制得ZnO,还有两种相对分子质量相差14 的产物,其中一种为初中常见的气体单质。则该反应的化学方程式为______。
【答案】ZnCO3![]() ZnO+CO2↑ CO32-或碳酸根离子 2Zn(NO3)2=2ZnO+4NO2↑+O2↑
ZnO+CO2↑ CO32-或碳酸根离子 2Zn(NO3)2=2ZnO+4NO2↑+O2↑
【解析】
(1)碳酸锌在高温的条件下分解生成氧化锌和二氧化碳,反应的方程式为:ZnCO3![]() ZnO+CO2↑。
ZnO+CO2↑。
(2)当碳酸钠过量时,溶液中还含有碳酸根离子。
(3)两种相对分子质量相差14 的产物,其中一种为初中常见的气体单质,则这两种物质是NO2和O2,故硝酸锌在高温的条件下分解生成氧化锌、二氧化氮和氧气,反应的方程式为:2Zn(NO3)2=2ZnO+4NO2↑+O2↑。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案【题目】钙元素对人类生命和生活具有重要意义,含钙的物质是中学化学研究的重要内容。
(1)牛奶中的钙主要以磷酸钙(Ca3(PO4)2 的形式存在,磷酸钙中磷元素的化合价为_____价。
(2)生石灰溶于水可制得熟石灰,该反应过程中能量的变化是_____(填“吸热”或“放热”)。
(3)氢化钙固体是登山运动员常用的能源提供剂某研究小组的同学通过查阅资料得知:氢化钙(CaH2)遇水反应生成氢氧化钙和氢气。该研究小组的同学把一定量的氢化钙加入到碳酸钠溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
(提出问题)滤液中溶质的成分是什么?
猜想一:氢氧化钠
猜想二:氢氧化钠、氢氧化钙
猜想三:氢氧化钠、碳酸钠
猜想四:氢氧化钠、碳酸钠、氢氧化钙
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明理由_____。
(实验验证)
实验 | 现象 | 结论 |
①取少量滤液,向其中滴加少量碳酸钠溶液 | 无明显现象 | 猜想_____不成立 |
②另取少量滤液,向其中滴加足量稀盐酸 | _____ | 猜想三成立 |
(反思与拓展)
①要证明猜想三成立,也可以另取少量滤液,向其中滴加_____。
②在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑_____。
③登山运动员携带氢化钙作为能源提供剂与携带氢气相比,其优点是_____(写一条即可)。