题目内容
【题目】兴趣小组的同学们在实验室里用下图装置来测定铜锌合金中锌的质量分数。若A中装入的是稀硫酸,则反应原理的化学方程式是________________________。
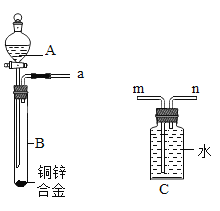
如图装置中,为测得氢气的体积,还需要增加的仪器是_________,导管接口的连接顺序应为a→________________(填“m”或“n”)。
若实验用铜锌合金的质量为ag,与酸充分反应后,测得氢气体积为V升,求出合金中锌的质量分数,还缺少一个数据是___________(填字母)
A.反应前加入稀酸的体积 B.反应前加入稀酸的质量分数
C.实验前反应装置中空气的体积 D.实验条件下氢气的密度
若用”称量B中剩余固体的质量从而计算锌的质量分数”的方法,来测定铜锌合金中锌的质量分数。请你写出主要的操作步骤及需要测量的数据__________。
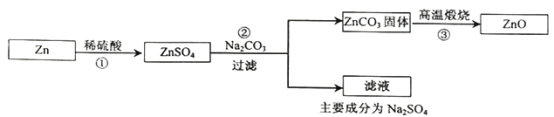
【答案】Zn +H2SO4 =ZnSO4 +H2↑ 量筒 n D 先称量铜锌合金的总质量,加入足量的稀硫酸,充分反应后过滤洗涤干燥,再称量剩余固体的质量
【解析】
由装置可知,若A中装入的是稀硫酸,根据金属活动性顺序表,铜不与稀硫酸反应,锌与稀硫酸反应生成了硫酸锌和氢气,反应原理的化学方程式是:Zn +H2SO4 =ZnSO4 +H2↑。
利用C装置和量筒测出生成的氢气的体积,根据密度可求出质量,再根据氢气的质量可求出锌的质量,即可求出锌的质量分数;因为氢气不溶于水,可用排水法,如图装置中,为测得氢气的体积,还需要增加的仪器是量筒,氢气密度比水小,导管接口的连接顺序应为a→n。
氢气体积为V升,若知道氢气的密度,根据密度可求出质量,再根据氢气的质量可求出锌的质量,已知铜锌合金的质量为ag,即可求出锌的质量分数。
若用“称量B中剩余固体的质量从而计算锌的质量分数”的方法,来测定铜锌合金中锌的质量分数,主要的操作步骤及需要测量的数据为:先称量铜锌合金的总质量,加入足量的稀硫酸,充分反应后过滤洗涤干燥,再称量剩余固体的质量。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案【题目】初中化学常见的3种元素X、Y和Z相关信息如下表所示
元素 | X | Y | Z |
相关信息 | 它的单质甲是一种清洁能源 | 地壳中含量最多的元素 | 它的一种单质乙是天然存在的最硬的物质 |
(1)甲的化学式是______,乙的名称是______
(2)ZY2可与Z的单质在高温条件下反应生成ZY,该反应的化学方程式是____________
(3)A、B、C是由上述3种元素中的一种或两种组成的单质或化合物,G由Ca、Y和Z三种元素组成。它们之间的转化关系如下图所示(“→”表示转化关系,部分反应物、生成物及反应条件已略去)
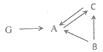
①G的化学式是________
②若A中不含X元素,则B的化学式为______C→A的化学方程式是________
③若A中不含Z元素,B→C的化学方程式是_________