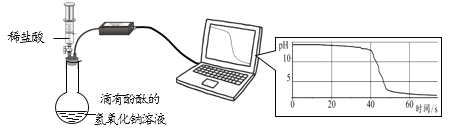
题目内容
【题目】钙元素对人类生命和生活具有重要意义,含钙的物质是中学化学研究的重要内容。
(1)牛奶中的钙主要以磷酸钙(Ca3(PO4)2 的形式存在,磷酸钙中磷元素的化合价为_____价。
(2)生石灰溶于水可制得熟石灰,该反应过程中能量的变化是_____(填“吸热”或“放热”)。
(3)氢化钙固体是登山运动员常用的能源提供剂某研究小组的同学通过查阅资料得知:氢化钙(CaH2)遇水反应生成氢氧化钙和氢气。该研究小组的同学把一定量的氢化钙加入到碳酸钠溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
(提出问题)滤液中溶质的成分是什么?
猜想一:氢氧化钠
猜想二:氢氧化钠、氢氧化钙
猜想三:氢氧化钠、碳酸钠
猜想四:氢氧化钠、碳酸钠、氢氧化钙
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明理由_____。
(实验验证)
实验 | 现象 | 结论 |
①取少量滤液,向其中滴加少量碳酸钠溶液 | 无明显现象 | 猜想_____不成立 |
②另取少量滤液,向其中滴加足量稀盐酸 | _____ | 猜想三成立 |
(反思与拓展)
①要证明猜想三成立,也可以另取少量滤液,向其中滴加_____。
②在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑_____。
③登山运动员携带氢化钙作为能源提供剂与携带氢气相比,其优点是_____(写一条即可)。
【答案】+5 放热 ![]() 二 滤液中有气泡冒出 足量稀硫酸或足量稀硝酸或含
二 滤液中有气泡冒出 足量稀硫酸或足量稀硝酸或含![]() 或
或![]() 的溶液如氯化钙溶液、硝酸钡溶液等 反应物是否有剩余 携带方便等
的溶液如氯化钙溶液、硝酸钡溶液等 反应物是否有剩余 携带方便等
【解析】
化合物中元素化合价代数和为零;氧化钙和水反应生成氢氧化钙,放热;碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,和稀盐酸反应生成氯化钠、水和二氧化碳,和氯化钙反应生成碳酸钙沉淀和氯化钠;氢气难于压缩,和空气或要求混合达到爆炸极限时,加热或遇明火会发生爆炸。
(1)磷酸钙中钙元素化合价是+2,氧元素化合价是-2,根据化合物中元素化合价代数和为零可知,磷元素的化合价为+5价;
(2)生石灰溶于水可制得熟石灰,该反应过程中能量的变化是放热;
(3)[提出问题]经过讨论,大家一致认为猜想四不合理,这是因为氢氧化钙和碳酸钠不能共存,反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
[实验验证]①取少量滤液,向其中滴加少量碳酸钠溶液,无明显现象,说明溶液中不含有氢氧化钙;
②另取少量滤液,向其中滴加足量稀盐酸,产生气泡,是因为稀盐酸和碳酸钠反应生成了二氧化碳,说明溶液中含有碳酸钠;
[反思与拓展]①要证明猜想三成立,也可以另取少量滤液,向其中滴加氯化钙溶液,这是因为氯化钙能和碳酸钠反应生成白色沉淀碳酸钙和氯化钠;
②在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑反应物是否过量;
③登山运动员携带氢化钙作为能源提供剂与携带氢气相比,其优点是安全、便于携带等。

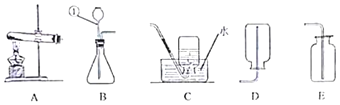
【题目】为探究盐酸的化学性质,某化学小组做了如下实验:
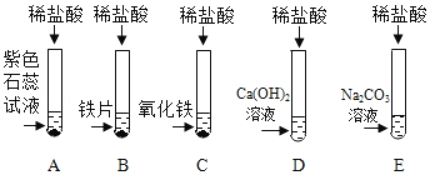
(1)A试管中的实验现象为_____,C试管中所发生反应的化学方程式为_____。
(2)将反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行探究。
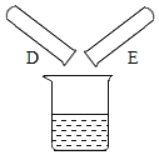
(提出问题)滤液中溶质的成分是什么?
(作出猜想)猜想:NaCl
猜想二:NaCl和CaCl2
猜想三:_____
猜想四:NaCl、Ca(OH)2和HCl
(进行讨论)经过讨论,同学们一致认为猜想_____是错误的。
(设计实验)请完成实验报告。
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,滴加适量的碳酸钠溶液。 | _____ | 猜想二不成立 |
取少量滤液于试管中,滴加_____(填名称)。 | _____ | 猜想三成立 |
(迁移拓展)稀盐酸、稀硫酸有一些相似的化学性质,是因为在不同的酸溶液中都含有_____。