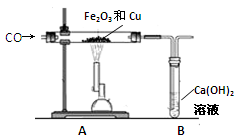
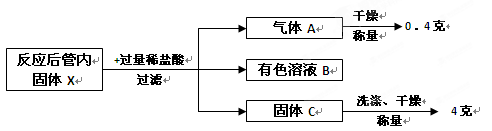
题目内容
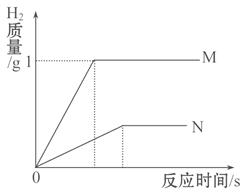
小敏对实验室用石灰石和稀盐酸制取二氧化碳后的废液,进行溶质成分鉴定。取废液上层清液50克,逐滴加入质量分数为26.5%的碳酸钠溶液,出现气泡,滴加至10克开始出现白色沉淀。继续滴加至沉淀不再产生,过滤,测得沉淀的质量为5克,并绘制了图像。
1)滴加的溶液中溶质属于 (选填“盐”或“碱”)。
2)10克碳酸钠溶液中含有的溶质质量是 克。
3)图像中的a点数值是 。
4)废液中含有的溶质是 。 (写化学式)。
5)通过计算说明,图像横坐标中的b点表示的溶液的质量是多少克?
1)盐 2)2.65 3)1.1 4)HCl、CaCl2 (每空一分) 5)30g
解析试题分析:1)滴加的碳酸钠属于盐类。
2)10g碳酸钠溶液中含溶质的质量为:10g╳26.5%=2.65g
3)图中a点表示生成气体的最大值。可利用二氧化碳与碳酸钠在反应中的质量关系进行求解。解题过程为:
解:设生成二氧化碳气体的质量为x
2HCl+Na2CO3= 2NaCl+H2O+CO2↑
106 44
2.65g x
106:44=2.65g:x
x=1.1g
所以a点的数值为1.1
4)反应生成的气体是碳酸钠与原来过量的稀盐酸反应生成的二氧化碳。当不再生成气体时,再加入碳酸钠生成白色沉淀,是因为原溶液中的氯化钙与碳酸钠反应的原因。所以可说明原溶液中含有稀盐酸(HCl)和氯化钙(CaCl2)。
5)b点是生成沉淀的质量为5g时,所加入的碳酸钠溶液的质量。其质量为和稀盐酸反应的碳酸钠溶液(10g)与和氯化钙反应的碳酸钠溶液的质量的和。
未知:和氯化钙反应的碳酸钠溶液的质量 已知:碳酸钙沉淀的质量为5g。
解题思路:可利用二者在化学方程式中的质量关系进行求解。
解:设与氯化钙反应的碳酸钠溶液中溶质质量为x,
CaCl2+Na2C03= 2NaCl+CaC03↓
106 100
x 5g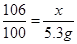
x=5.3g
溶液质量是5.3g÷26.5%=20g
b点质量应标20g+10g=30g
答:b点表示的溶液的质量是30g
考点:根据化学方程式的计算

 Na2SO4+2H2O+2NH3↑; 2NH3+H2SO4=(NH4)2SO4。
Na2SO4+2H2O+2NH3↑; 2NH3+H2SO4=(NH4)2SO4。
 Na2SO4+2NH3↑+2H2O,
Na2SO4+2NH3↑+2H2O,