题目内容
实验课上,张影同学向盛有澄清石灰水的烧杯中加入过量的碳酸钠溶液,生成白色沉淀,过滤后得到无色溶液,他说:“我制得了氢氧化钠溶液!”
(1)余承骏同学却说:“这种无色溶液中不一定含有氢氧化钠。”他做了如下实验:
| 实验步骤 | 实验现象 | 实验结论 |
| 用试管取无色溶液少许,滴入2滴无色酚酞试液 | 无色酚酞试液变红 | 无色溶液中含有氢氧化钠 |
宋楷认为余承骏的实验方案不严密,不能证实无色溶液中一定含有氢氧化钠,理由是: 。
(2)宋楷设计了另一个实验:
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量样品于试管中,加入足量的CaCl2溶液 ②过滤,向滤液中滴加几滴硫酸铜溶液 | ③ ④有蓝色沉淀生成 | 无色溶液中确实含有氢氧化钠 |
(3)宋楷的实验可靠性高的原因是 。
(1)碳酸钠溶液呈碱性,也能使酚酞试液变红
(2)有白色沉淀生成
(3)排除了碳酸钠溶液的干扰,加入硫酸铜溶液有蓝色沉淀生成,证明溶液中一定有氢氧化钠
解析试题分析:(1)用无色酚酞来检验氢氧化钠是否存在,显然不够合理,因为碳酸钠溶液呈碱性,也能使酚酞试液变红
(2)取少量样品于试管中,加入足量的CaCl2溶液,如果有碳酸钠存在,那发生了这样的反应:Na2CO3+CaCl2=CaCO3↓+2NaCl,有白色沉淀碳酸钙生成生成
(3)当加入了足量的CaCl2溶液后,溶液中存在的碳酸钠全部被反应完全,即排除了碳酸钠溶液的干扰,加入硫酸铜溶液有蓝色沉淀生成,证明溶液中一定有氢氧化钠,故宋楷的实验可靠性高
考点:氢氧化钠和碳酸钠的化学性质

 科学实验活动册系列答案
科学实验活动册系列答案(6分)依据表中的元素所组成初中化学常见的物质,回答下列问题。
| 元素名称 | 氢 | 碳 | 氧 | 氯 | 钠 | 钙 |
| 元素符号 | H | C | O | Cl | Na | Ca |
(1)A、B组成元素相同,一定条件下可发生反应A→B+C,则C物质是______。
(2)D、E、F含有相同的金属元素,F俗称小苏打,已知在溶液中D与F反应生成E和B,则该反应的化学方程式为_____________________。
(3)向某红色溶液中滴加D溶液,溶液颜色经历红色→紫色→蓝色的变化过程,且无气体、无沉淀产生。则原红色溶液中的溶质是_______________,D物质是______________。
(4)向X物质的饱和溶液中加入物质Y,溶液变浑浊,在向其中加入足量稀盐酸,溶液变澄清、无气体产生。则溶液变浑浊的原因是__________[填序号]。
①X是Ca(OH)2、加入的物质Y是CO2,二者发生反应生成CaCO3;
②X是Na2CO3、加入的物质Y是Ca(OH)2,二者发生反应生成CaCO3;
③X是Ca(OH)2、加入的物质Y是CaO,CaO与水反应消耗溶剂使Ca(OH)2析出;
④X是Ca(OH)2、加入的物质Y是CaO,CaO与水反应生成的Ca(OH)2不能再溶解;
⑤X是Ca(OH)2、加入的物质Y是CaO,CaO与水反应放热使Ca(OH)2溶解度减小而析出;
实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样。已知它是无色液体,是初中化学常用的试剂。小强和小华同学很感兴趣,决定对其成分进行探究:
提出问题:这瓶试剂可能是什么溶液呢?
交流讨论:根据受损标签的情况判断,这瓶试剂不可能是
A.酸 B.碱 C.盐
查阅资料:Ⅰ.初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。
Ⅱ.Na2CO3和NaHCO3溶液都呈碱性。
Ⅲ.测定室温(20℃)时,四种物质的溶解度的数据如下:
| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度g | 36 | 109 | 215 | 9.6 |
得出结论:小华根据试剂瓶标注的溶质质量分数10%和上表中的溶解度的数据判断,这瓶试剂不可能是 。
设计实验并继续探究:
(1)小强用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH>7,这瓶试剂不可能是 。
(2)小强为了确定该溶液是哪种溶液,他又进行了如下实验:
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样于试管中,滴加 | 产生大量的气泡 | 该溶液是 |
拓展与应用:确定该溶液还可以选择与小强不同的试剂,你选择的试剂是 (要求类别不同)。
钢铁是人类生活和生产中非常重要的材料。
(3)工业炼铁的反应过程如下图所示,其中焦炭的作用是燃烧提供能量和 。

(4)在工业冶炼中要得到224t,理论上需要含Fe2O380%,的赤铁矿石的质量是多少?
某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动。以下是教学片段,请你参与学习并帮助填写空格(包括表中空格)。
【演示实验】将一定量的稀硫酸加入到盛有NaOH溶液的小烧杯中。
【学生板演】该反应的化学方程式______________。
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,大家纷纷提出猜想。甲组同学的猜想如下:
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH
猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的。不合理的猜想是
____________________。
【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有____________。
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究。
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 |  | 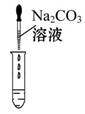 | 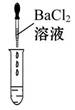 |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【得出结论】通过探究,全班同学一致确定猜想二是正确的。
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定。同时指出【实验探究】(2)中存在两处明显错误,请大家反思。同学们经过反思发现了这两处错误:
(1)实验操作中的错误是____________________。
(2)实验方案中也有一个是错误的,错误的原因是_____________________。