题目内容
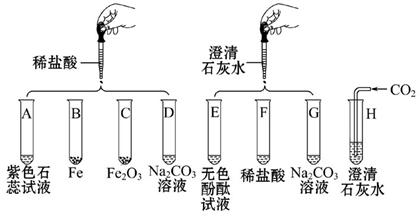
(6分)依据表中的元素所组成初中化学常见的物质,回答下列问题。
| 元素名称 | 氢 | 碳 | 氧 | 氯 | 钠 | 钙 |
| 元素符号 | H | C | O | Cl | Na | Ca |
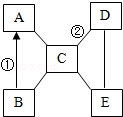
(1)A、B组成元素相同,一定条件下可发生反应A→B+C,则C物质是______。
(2)D、E、F含有相同的金属元素,F俗称小苏打,已知在溶液中D与F反应生成E和B,则该反应的化学方程式为_____________________。
(3)向某红色溶液中滴加D溶液,溶液颜色经历红色→紫色→蓝色的变化过程,且无气体、无沉淀产生。则原红色溶液中的溶质是_______________,D物质是______________。
(4)向X物质的饱和溶液中加入物质Y,溶液变浑浊,在向其中加入足量稀盐酸,溶液变澄清、无气体产生。则溶液变浑浊的原因是__________[填序号]。
①X是Ca(OH)2、加入的物质Y是CO2,二者发生反应生成CaCO3;
②X是Na2CO3、加入的物质Y是Ca(OH)2,二者发生反应生成CaCO3;
③X是Ca(OH)2、加入的物质Y是CaO,CaO与水反应消耗溶剂使Ca(OH)2析出;
④X是Ca(OH)2、加入的物质Y是CaO,CaO与水反应生成的Ca(OH)2不能再溶解;
⑤X是Ca(OH)2、加入的物质Y是CaO,CaO与水反应放热使Ca(OH)2溶解度减小而析出;
(1)O2 (2)NaHCO3+NaOH=Na2CO3+H2O
(3)HCl和紫色石蕊 NaOH (4) 3、4、5
解析试题分析:(1)A、B组成元素相同,一定条件下可发生反应A→B+C,可以推断A应该是过氧化氢溶液,发生分解反应,生成B是水,同时还生成氧气,所以C物质是O2
(2)D、E、F含有相同的金属元素,F俗称小苏打,即碳酸氢钠,而D、E、F含有相同的金属元素,即钠元素,已知在溶液中D与F反应生成E和B(水),依据表中提供的元素种类,可以推出是NaHCO3和NaOH发生反应,该反应的化学方程式为:NaHCO3+NaOH=Na2CO3+H2O
(3)向某红色溶液中滴加D溶液,溶液颜色经历红色→紫色→蓝色的变化过程,且无气体、无沉淀产生,明显是紫色石蕊试液遇酸碱变色的情况,紫色石蕊在酸溶液中变红,在中性溶液显紫色,在碱性溶液中显蓝色,所以则原红色溶液中的溶质是:HCl和紫色石蕊,D物质是:NaOH溶液
(4)向变浑浊的溶液中加入足量稀盐酸,溶液变澄清、无气体产生,说明这种浑浊的物质能与盐酸反应,但不会生成气体,所以排除了不溶性的碳酸盐,故①②都错误,③X是Ca(OH)2、加入的物质Y是CaO,CaO与水反应消耗溶剂使Ca(OH)2析出,正确,④X是Ca(OH)2、加入的物质Y是CaO,CaO与水反应生成的Ca(OH)2不能再溶解,正确,⑤X是Ca(OH)2、加入的物质Y是CaO,CaO与水反应放热使Ca(OH)2溶解度减小而析出,正确
考点:制取氧气的原理,酸、碱的化学性质,Ca(OH)2的溶解度

 阅读快车系列答案
阅读快车系列答案某化学课堂围绕,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格)。
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中。
【学生板演】该反应的化学方程式 。
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,太家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是 。
【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有 。
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaC12溶液、Na2CO3溶液,进行如下三个方案的探究.
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 |  |  |  |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 。 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出【实验探究】(2)中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:
(1)实验操作中的错误是 。
(2)实验方案中也有一个是错误的,错误的原因是 。
实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样。已知它是无色液体,是初中化学常用的试剂。
(1)根据受损标签的情况判断,这瓶试剂不可能是
A.酸 B.碱 C.盐
(2) 已知 Ⅰ.初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。
Ⅱ.Na2CO3和NaHCO3溶液都呈碱性。
Ⅲ.室温(20℃)时,四种物质的溶解度的数据如下图:
| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度g | 36 | 109 | 215 | 9.6 |
根据试剂瓶标注的溶质质量分数10%和右表中的溶解度的数据判断,这瓶试剂不可能是 。
(3) 用pH试纸上测得该溶液的pH>7,这瓶试剂不可能是 。
(4) 为了确定该溶液是哪种溶液,现进行如下进一步的实验:
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样于试管中,滴加 | 产生大量的气泡 | 该溶液是 ,反应的化学方程式 |
(6) 为了探究一瓶氯化钙溶液的质量分数,取该溶液50g,加入50g碳酸钾溶液,恰好完全反
应,所得溶液质量95g,计算此氯化钙溶液的质量分数。
学完酸碱盐知识后,小美对妈妈焙制糕点用的小苏打很感兴趣,她把小苏打带到实验室与小刚一起进行探究。
(1)小美取少量小苏打溶于水,滴加酚酞试液后,溶液变红,说明小苏打的水溶液显 性;
(2)小刚在烧杯内放入少量小苏打,向其中滴加稀盐酸,立即有 产生,说明小苏打能与酸反应。在医疗上可以用小苏打治疗 ;
(3)小美想:糕点非常松软,是不是小苏打受热分解产生了CO2气体呢?于是她用下图装置对小苏打进行加热,一段时间后,导管口的确有气泡冒出,澄清石灰水变浑浊,同时试管口有水珠生成。
当导管口不再有气泡产生时,试管内仍有白色固体,她猜测剩余固体可能是:①NaOH;②Na2CO3;③NaCl。小刚认为猜想
一定不正确,理由是 。小刚从试管内取少量白色固体溶于水,滴加酚酞,溶液变红,他判断该固体为NaOH,小美认为他的实验设计不合理,因为
(4)小美和小刚继续探究固体成分,设计了如下实验:
| 操作步骤 | 实验现象 | 结论 |
| 取少量白色固体于试管中,加水溶解,向其中滴加 溶液 | 产生白色沉淀 | 试管内剩余的固体为Na2CO3 |
实验课上,张影同学向盛有澄清石灰水的烧杯中加入过量的碳酸钠溶液,生成白色沉淀,过滤后得到无色溶液,他说:“我制得了氢氧化钠溶液!”
(1)余承骏同学却说:“这种无色溶液中不一定含有氢氧化钠。”他做了如下实验:
| 实验步骤 | 实验现象 | 实验结论 |
| 用试管取无色溶液少许,滴入2滴无色酚酞试液 | 无色酚酞试液变红 | 无色溶液中含有氢氧化钠 |
宋楷认为余承骏的实验方案不严密,不能证实无色溶液中一定含有氢氧化钠,理由是: 。
(2)宋楷设计了另一个实验:
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量样品于试管中,加入足量的CaCl2溶液 ②过滤,向滤液中滴加几滴硫酸铜溶液 | ③ ④有蓝色沉淀生成 | 无色溶液中确实含有氢氧化钠 |
(3)宋楷的实验可靠性高的原因是 。