题目内容
 一化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.
一化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.【资料获悉】铁系“脱氧剂”的作用原理是利用铁能被氧气氧化,从而达到除氧保鲜的目的.铁被氧气氧化最终产物为红棕色的Fe2O3.
小组同学欲探究该“脱氧剂”是否已经失效(即单质铁是否已经完全被氧化),设计了以下探究实验.
【实验探究】
步骤1:小刚用磁铁接近样品,发现磁铁吸引了部分黑色固体.
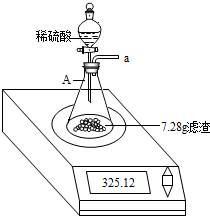
步骤2:称取10.00g样品于一烧杯中,加足量水充分搅拌溶解后,过滤,将滤渣洗涤、干燥、称得其质量为7.28g.
步骤3:按如图装置,将得到的7.28g固体与足量稀硫酸反应,用电子秤称得反应前后总质量差为0.15g.
步骤4:将锥形瓶中反应后的液体过滤,并将滤渣洗涤、干燥后,称得其质量为1.20g.
【交流讨论】
(1)由步骤1得出的结论是
(2)步骤2目的是
(3)小华提出在装置的a导管处应该再连接一个盛有碱石灰的干燥管,他这样做的理由是
(4)小明认为步骤3中0.15g差值即为H2的质量,并由此计算出样品中单质铁的质量为4.20g.你认为是否合理
(5)如果步骤4中滤渣没有经过洗涤,则称得的质量
考点:药品是否变质的探究,金属的化学性质,根据化学反应方程式的计算
专题:科学探究
分析:(1)根据单质的铁能被磁铁吸附分析;
(2)根据氯化钠能溶于水,铁粉、活性炭不易溶于水,可通过加水溶解掉氯化钠,根据氯离子的检验方法分析溶质的检验;
(3)根据碱石灰能吸收水分进行分析;
(4)因为氧化铁与稀硫酸反应有水生成,所以应该在装置的a导管处应该再连接一个盛有碱石灰的干燥管,从而除去H2中的水蒸气;
(5)根据滤渣表面粘附少量溶质分析.
(2)根据氯化钠能溶于水,铁粉、活性炭不易溶于水,可通过加水溶解掉氯化钠,根据氯离子的检验方法分析溶质的检验;
(3)根据碱石灰能吸收水分进行分析;
(4)因为氧化铁与稀硫酸反应有水生成,所以应该在装置的a导管处应该再连接一个盛有碱石灰的干燥管,从而除去H2中的水蒸气;
(5)根据滤渣表面粘附少量溶质分析.
解答:解:(1)由用磁铁接近样品,发现磁铁吸引了部分黑色固体,说明了样品中含有单质的铁;
(2)将样品加足量水充分搅拌溶解,将样品中的氯化钠溶解掉了.检验该滤液中溶质的方法是取少量滤液于试管中,滴加硝酸银溶液,产生白色沉淀,说明溶质为氯化钠;
(3)因为氧化铁与稀硫酸反应有水生成,所以应该在装置的a导管处应该再连接一个盛有碱石灰的干燥管,从而除去H2中的水蒸气;
(4)样品在稀硫酸中除了Fe、Fe2O3分别能与稀硫酸反应外,还存在反应:Fe+Fe2(SO4)3=3FeSO4.因此,小明用产生H2的质量计算样品中铁的质量不合理.实际上,样品中单质铁的质量应该是与酸反应消耗的铁和与Fe2(SO4)3反应消耗铁的质量总和;
(5)由于滤渣表面粘附少量溶质,所以,称得的质量大于1.20g.
故答案为:(1)“脱氧剂”没有失效;(2)溶解样品中氯化钠;取少量滤液于试管中,滴加硝酸银溶液,产生白色沉淀,说明溶质为氯化钠;(3)防止氢气排出时带出一部分水,使得氢气质量增加,减少对氢气质量的测定产生的误差;(4)否;(5)>.
(2)将样品加足量水充分搅拌溶解,将样品中的氯化钠溶解掉了.检验该滤液中溶质的方法是取少量滤液于试管中,滴加硝酸银溶液,产生白色沉淀,说明溶质为氯化钠;
(3)因为氧化铁与稀硫酸反应有水生成,所以应该在装置的a导管处应该再连接一个盛有碱石灰的干燥管,从而除去H2中的水蒸气;
(4)样品在稀硫酸中除了Fe、Fe2O3分别能与稀硫酸反应外,还存在反应:Fe+Fe2(SO4)3=3FeSO4.因此,小明用产生H2的质量计算样品中铁的质量不合理.实际上,样品中单质铁的质量应该是与酸反应消耗的铁和与Fe2(SO4)3反应消耗铁的质量总和;
(5)由于滤渣表面粘附少量溶质,所以,称得的质量大于1.20g.
故答案为:(1)“脱氧剂”没有失效;(2)溶解样品中氯化钠;取少量滤液于试管中,滴加硝酸银溶液,产生白色沉淀,说明溶质为氯化钠;(3)防止氢气排出时带出一部分水,使得氢气质量增加,减少对氢气质量的测定产生的误差;(4)否;(5)>.
点评:解答本题的关键是要掌握铁的物理性质和化学性质两方面的知识及其化学方程式的书写方法,只有这样才能对问题做出正确的判断.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
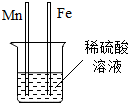
有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而Z没有变化.根据以上实验事实判断,以下金属活动性由强到弱的顺序是( )
| A、Y Ag Z X |
| B、Y X Z Ag |
| C、X Y Ag Z |
| D、X Ag Y Z |
 铁、铜、金、锰在生活和生产中有广泛的用途.请回答以下问题:
铁、铜、金、锰在生活和生产中有广泛的用途.请回答以下问题: 为了让不爱吃蔬菜的学生营养均衡,家长把榨好的各种颜色的蔬菜汁放在面粉里和面,做成口味独特、营养丰富的蔬菜馒头.这种馒头为人体提供的营养素是
为了让不爱吃蔬菜的学生营养均衡,家长把榨好的各种颜色的蔬菜汁放在面粉里和面,做成口味独特、营养丰富的蔬菜馒头.这种馒头为人体提供的营养素是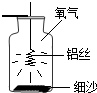 小强同学经过查阅资料得知:铝丝和铁丝一样,也能在氧气中燃烧,于是设计了如图所示的装置进行实验探究,请你结合实验过程回答下列问题.
小强同学经过查阅资料得知:铝丝和铁丝一样,也能在氧气中燃烧,于是设计了如图所示的装置进行实验探究,请你结合实验过程回答下列问题.