题目内容
【题目】在探究金属与酸的反应时,发现铜片与20%的硫酸溶液不反应。有同学提出疑问“在一定条件下铜与硫酸能否发生反应”,并进行了系列实验。
(查阅资料)SO2能让红色的品红溶液褪色,能被NaOH溶液吸收。
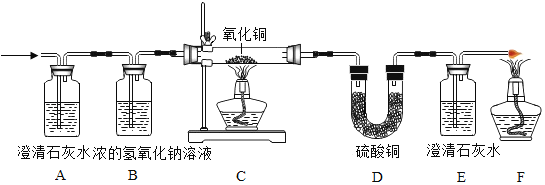
(进行实验)(夹持仪器略)
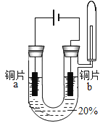
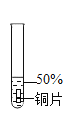
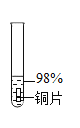
实验1:初步实验(所用溶液均为硫酸溶液)
实验序号 | 1﹣1 | 1﹣2 | 1﹣3 | 1﹣4 | 1﹣5 |
装置 |
|
|
|
|
|
主要现象 | 铜片a附近溶液逐渐变蓝,铜片b附近产生无色气泡。 | 无明显现象 | 无明显现象 | 无明显现象 | 铜片溶解,溶液变蓝,生成有刺激性气味的无色气体 |
经检验实验1﹣1中产生的气体是氢气。
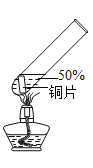
实验2:在实验1﹣5的基础上深入探究,装置如图。

(解释与结论)
(1)实验1﹣1中,能证明铜发生反应的现象是_____。
(2)实验1中,欲得出“升高温度可使铜与硫酸反应”需对比的实验是_____(填实验序号)。
(3)补全实验1﹣5和实验2中铜与硫酸反应的化学方程式:![]() _____
_____
(4)与实验1﹣5相比,实验2的优点有_____(写出一条即可)。
(5)通过上述实验能得出的结论是_____。
(反思与评价)
(6)下列说法不正确的是_____。
A 对比实验1﹣2和1﹣5,可得出“增大浓度可使铜与硫酸反应”
B 通电可促进一些化学反应的发生
C 铜与硫酸只能发生一种化学反应
【答案】溶液变蓝 1﹣3和1﹣5 2H2O 进行了尾气处理,防止污染空气 在一定条件下,铜与硫酸能发生反应 AC
【解析】
(1)化学变化的实质是有新物质生成,故能证明铜发生化学反应的现象是溶液变蓝,说明生成了铜离子;
(2)除了温度这个变量之外其他的变量都要相同,而且还需最后的现象不同,故需对比的实验为1﹣3和1﹣5;
(3)根据质量守恒定律可知反应前后元素的种类和原子个数不变,反应物中有1个铜原子、4个氢原子、2个硫原子和8个氧原子,生成物中也应该有相应的原子种类和个数,故化学方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(4)从两个实验装置的特点可知,实验2验证了产生的气体是SO2,实验1﹣5不能验证产生是什么气体,实验2进行了尾气处理,防止污染空气;长导管可防止倒吸;反应停止后从长导管鼓入空气,可将SO2充分吸收,实验1﹣5没有尾气处理装置,故与实验1﹣5相比,实验2的优点有:验证了产生的气体是SO2;进行了尾气处理,防止污染空气;长导管可防止倒吸;反应停止后从长导管鼓入空气,可将SO2充分吸收等;
(5)通过观察实验现象可以得出如下结论:在一定条件下,铜与硫酸能发生反应;
(6)A、在进行实验对比的时候,要控制只有一个变量,实验1﹣2和1﹣5有两个变量,符合题意;
B、根据实验1-1,通电可促进一些化学反应的发生,不符合题意;
C、无法确定铜与硫酸只能发生一种化学反应,符合题意。故选AC。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案【题目】小苏打(主要成分为NaHCO3)中常含有少量氯化钠.化学小组的同学为了测定小苏打中NaHCO3的质量分数,进行了以下实验:将样品置于烧杯中,向其中慢慢滴加稀盐酸,至不再产生气泡为止,测得的有关数据如下表所示.
物 质 | 样 品 | 消耗稀盐酸质量 | 反应后溶液质量 |
质量(g) | 9 | 75.4 | 80 |
计算:
(1)样品中的NaHCO3质量分数;
(2)所得溶液中溶质的质量分数.