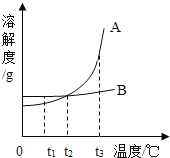
题目内容
【题目】将30g黄铜(Cu﹣Zn合金)与100g稀硫酸在烧杯中恰好完全反应,反应后测得烧杯中剩余物的总质量为129.6g。已知锌与硫酸反应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑。求:
(1)反应生成氢气的质量为_____g
(2)稀硫酸的溶质的质量分数(计算结果精确到0.1%)。_____。
【答案】0.4 19.6%
【解析】
根据质量守恒定律可知,过程中质量的减少是因为生成了氢气,所以可以求算氢气的质量,根据氢气的质量和对应的化学方程式求算稀硫酸的溶质的质量分数。
解:(1)根据质量守恒定律可得,生成的氢气的质量为30g+100g﹣129.6g=0.4g;
(1)设稀硫酸的溶质的质量分数为x,
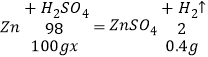
![]()
x=19.6%,
答:(1)反应生成氢气的质量为 0.4g;
(2)稀硫酸的溶质的质量分数19.6%。

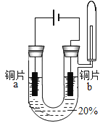
【题目】在探究金属与酸的反应时,发现铜片与20%的硫酸溶液不反应。有同学提出疑问“在一定条件下铜与硫酸能否发生反应”,并进行了系列实验。
(查阅资料)SO2能让红色的品红溶液褪色,能被NaOH溶液吸收。
(进行实验)(夹持仪器略)
实验1:初步实验(所用溶液均为硫酸溶液)
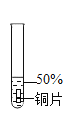
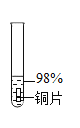
实验序号 | 1﹣1 | 1﹣2 | 1﹣3 | 1﹣4 | 1﹣5 |
装置 |
|
|
|
|
|
主要现象 | 铜片a附近溶液逐渐变蓝,铜片b附近产生无色气泡。 | 无明显现象 | 无明显现象 | 无明显现象 | 铜片溶解,溶液变蓝,生成有刺激性气味的无色气体 |
经检验实验1﹣1中产生的气体是氢气。
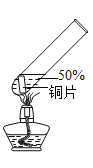
实验2:在实验1﹣5的基础上深入探究,装置如图。

(解释与结论)
(1)实验1﹣1中,能证明铜发生反应的现象是_____。
(2)实验1中,欲得出“升高温度可使铜与硫酸反应”需对比的实验是_____(填实验序号)。
(3)补全实验1﹣5和实验2中铜与硫酸反应的化学方程式:![]() _____
_____
(4)与实验1﹣5相比,实验2的优点有_____(写出一条即可)。
(5)通过上述实验能得出的结论是_____。
(反思与评价)
(6)下列说法不正确的是_____。
A 对比实验1﹣2和1﹣5,可得出“增大浓度可使铜与硫酸反应”
B 通电可促进一些化学反应的发生
C 铜与硫酸只能发生一种化学反应