ЬтФПФкШн
ЁОЬтФПЁПШЫРрЗЂеЙЕФРњЪЗНјГЬжаШЫУЧВЛЖЯбажЦГіИїжжВЛЭЌЕФгУОпЃЌжЦдьгУОпЕФВФСЯвВдкВЛЖЯЕиЗЂЩњБфЛЏЃЌН№ЪєжЦЦЗвђЦфУРЙлЁЂФЭгУЁЂЧсБувзГЩаЭЖјБЛШЫУЧЙуЗКРћгУЃЌЧыИљОнЫљбЇжЊЪЖМАЩњЛюжЊЪЖВЮгыгаЙиН№ЪєжЦЦЗЬНОПЁЃ
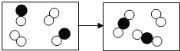
ЃЈвЛЃЉвдЯТЙЄОпЕФжЦзїЙ§ГЬжаУЛгаЗЂЩњЛЏбЇБфЛЏЕФЪЧ_____ЁЃ
AдЪМШЫжЦзїЪЏЕЖ BвБСЖЧрЭ CСЖЬњ
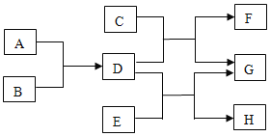
ЃЈЖўЃЉЧыНЋвдЯТН№ЪєВФСЯЕФвБСЖАДФъДњЕФЯШКѓЫГађХХађ_____ЃЈЬюађКХЃЉЁЃ
AЬњ BЧрЭ CТС
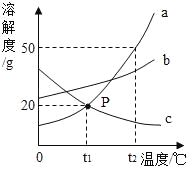
ДгвдЩЯЫГађПЩвдПДГіЃЌН№ЪєжЦЦЗЕФГіЯжЫГађгы_____гаЙиЃЌФЧУДН№ЪєМиЕФжЦЕУгІХХдк_____ЃЈЬюађКХЃЉжЎКѓЁЃ
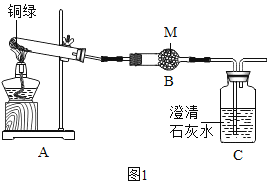
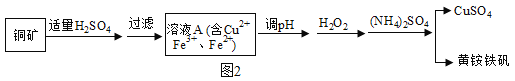
ЃЈШ§ЃЉЭЦїЪЧЩњЛюжаГЃМћЮяЦЗЃЌЭЦїБЃДцВЛЩЦЃЌБэУцЛсЩњГЩвЛВуТЬЩЋЭатCu2ЃЈOHЃЉ 2CO3ЃЎЭЩњатЕФЬѕМўГ§СЫЫЎКЭбѕЦјЭтЛЙашвЊ_____ЃЈаДЛЏбЇЪНЃЉЁЃ
ЃЈЫФЃЉЮЊСЫЬНОПМюЪНЬМЫсЭЕФЛЏбЇаджЪКЭзщГЩЃЌИУаЁзщЭЌбЇШЁЩйСПЭТЬЃЈМйЩшдгжЪВЛВЮгыЗДгІЃЉАДШчЭМзАжУНјааЪЕбщЃК
вбжЊЃКIЃЎЭТЬЕФжївЊГЩЗжЪЧМюЪНЬМЫсЭЁЃ
ЂђЃЎЭЦївђЫљДІЛЗОГВЛЭЌЃЌЩњГЩЕФЭТЬжаПЩФмЛЙКЌгаCuSO4КЭCuCl2ЁЃ
ЂѓЃЎСђЫсЭЁЂТШЛЏЭЕФЛЏбЇаджЪЮШЖЈЃЌОЦОЋЕЦМгШШЬѕМўЯТВЛЗжНтЁЃ
ЃЈ1ЃЉMвЉЦЗЕФУћГЦЪЧ_____ЁЃ
ЃЈ2ЃЉаДГіCu2ЃЈOHЃЉ2CO3ЗжНтЕФЛЏбЇЗНГЬЪН_____ЁЃ
ЃЈ3ЃЉЪЕбщЙ§ГЬжаЃЌЗЂЯжAжаТЬЩЋЙЬЬхж№НЅБфЮЊКкЩЋЃЌBжаЙЬЬхБфРЖЩЋЃЌCжаЯжЯѓЮЊ_____ЃЌДЫДІЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_____ЁЃ
ЃЈ4ЃЉЮЊСЫбщжЄЭТЬжаЪЧЗёгаCuSO4КЭCuCl2ЃЌИУаЁзщЭЌбЇНјааСЫШчЯТЪЕбщЃЌЧыВЙГфЭъГЩЯТСаЪЕбщБЈИцЃК
ВНжш | Вйзї | ЯжЯѓМАНсТл |
Ђй | ШЁЩйСПЭТЬШмгкзуСПЯЁЯѕЫсжаЃЌВЂНЋШмвКЗжГЩМзЁЂввСНЗн | ВњЩњЦјХн |
Ђк | ЯђМзжаЕЮМгЯѕЫсБЕШмвК | ШєЙлВьЕН_____ЃЌдђЭТЬжаКЌгаCuSO4 |
Ђл | ЯђввжаМгШыЙ§СПЕФЯѕЫсБЕШмвКЃЌеёЕДЁЂОВжУЃЌШЁЩЯВуЧхвКгкЪдЙмжаЃЌдйЕЮМг_____ЁЃ | ШєЙлВьЕНВњЩњАзЩЋГСЕэЃЌдђЭТЬжаКЌгаCuCl2 |
ЃЈЮхЃЉвбжЊЃК
ЂйЭПѓПѓЪЏжаКЌгаCu2ЃЈOHЃЉ2CO3МАКЌЬњдЊЫиЕФдгжЪЃЛ
ЂкЛЦяЇЬњЗЏЕФЛЏбЇЪНЮЊ ЃЈNH4ЃЉxFeyЃЈSO4ЃЉmЃЈOHЃЉnЃЌЦфжаЬњЮЊ+3МлЁЃ
ЂлдкЛЏбЇжаFe3O4ПЩвдБэЪОЮЊFeOFe2O3
ФГаЫШЄаЁзщРћгУИУЭПѓЪЏжЦЛЦяЇЬњЗЏЕФСїГЬШчЭМ2ЃК
ЃЈ1ЃЉвдбѕЛЏЮяЕФаЮЪНБэЪОCu2ЃЈOHЃЉ2CO3ЕФзщГЩЮЊ_____ЃЌ111gCu2 ЃЈOHЃЉ2CO3гыЯЁH2SO4ЗДгІЪБЯћКФH2SO4ЕФжЪСПЮЊ_____gЁЃ
ЃЈ2ЃЉИУаЁзщЮЊВтЖЈЛЦяЇЬњЗЏЕФзщГЩЃЌНјааСЫШчЯТЪЕбщЃК
aЃЎГЦШЁmgбљЦЗЃЌМгбЮЫсЭъШЋШмНтКѓЃЌНЋЫљЕУШмвКЗжЮЊСНЕШЗнЃЛ
bЃЎЯђвЛЗнжаМгШызуСПNaOHШмвКВЂМгШШЃЌЪеМЏЕН0.0425gЕФЦјЬхЃЈМйЩшЦјЬхШЋВПвнГіЃЉЁЃНЋЫљЕУГСЕэЙ§ТЫЁЂЯДЕгЁЂзЦЩежСКужиЃЌЕУЕНКьзиЩЋЗлФЉ0.600gЁЃ
cЃЎЯђСэвЛЗнжаМгзуСПBaCl2ШмвКГфЗжЗДгІКѓЃЌЙ§ТЫЁЂЯДЕгЁЂИЩдяЕУГСЕэ1.165gЁЃ
ЂйЛЦяЇЬњЗЏжаNH4+гыSO42ЉЕФИіЪ§БШЮЊ_____ЁЃ
ЂкЭЈЙ§МЦЫуШЗЖЈЛЦяЇЬњЗЏЕФЛЏбЇЪН_____ЁЃЃЈаДГіМЦЫуЙ§ГЬЃЉ
ЁОД№АИЁПA BЁЂAЁЂC Н№ЪєЛюЦУад C CO2 ЮоЫЎСђЫсЭ Cu2ЃЈOHЃЉ2CO3![]() 2CuO+H2O+CO2Ёќ ГЮЧхЪЏЛвЫЎБфЛызЧ CaЃЈOHЃЉ2+CO2ЈTCaCO3Ё§+H2O АзЩЋГСЕэ ЯѕЫсвјШмвК 2CuOH2OCO2 98 1ЃК2 NH4Fe3ЃЈSO4ЃЉ2ЃЈOHЃЉ6
2CuO+H2O+CO2Ёќ ГЮЧхЪЏЛвЫЎБфЛызЧ CaЃЈOHЃЉ2+CO2ЈTCaCO3Ё§+H2O АзЩЋГСЕэ ЯѕЫсвјШмвК 2CuOH2OCO2 98 1ЃК2 NH4Fe3ЃЈSO4ЃЉ2ЃЈOHЃЉ6
ЁОНтЮіЁП
ЃЈвЛЃЉвдЯТЙЄОпЕФжЦзїЙ§ГЬжаУЛгаЗЂЩњЛЏбЇБфЛЏЕФЪЧдЪМШЫжЦзїЪЏЕЖЃЌЙЪЬюAЁЃ
ЃЈЖўЃЉвдЯТН№ЪєВФСЯЕФвБСЖАДФъДњЕФЯШКѓЫГађЪЧЧрЭЁЂЬњЁЂТСЃЌЙЪЬюBЁЂAЁЂCЃЛ
ДгвдЩЯЫГађПЩвдПДГіЃЌН№ЪєжЦЦЗЕФГіЯжЫГађгыН№ЪєЛюЦУадгаЙиЃЌЙЪЬюН№ЪєЛюЦУадЃЛ
гЩМИжжН№ЪєЪЙгУЕФЫГађПЩжЊЃЌН№ЪєЕФЛюЖЏаддНЧПЃЌдкЪЙгУЫГађжадНППКѓЃЌФЧУДН№ЪєМиБШТСЛюЦУЃЌН№ЪєМиЕФПЊЪМЪЙгУЪБМфгІХХдкТСжЎКѓЃЌЙЪЬюCЁЃ
ЃЈШ§ЃЉЭЦїЪЧЩњЛюжаГЃМћЮяЦЗЃЌЭЦїБЃДцВЛЩЦЃЌБэУцЛсЩњГЩвЛВуТЬЩЋЭатCu2ЃЈOHЃЉ 2CO3ЃЌгЩжЪСПЪиКуЖЈТЩПЩжЊЃЌЭЩњатЕФЬѕМўГ§СЫЫЎКЭбѕЦјЭтЛЙашвЊCO2ЃЌЙЪЬюCO2ЁЃ
ЃЈЫФЃЉЃЈ1ЃЉMвЉЦЗЕФУћГЦЪЧЮоЫЎСђЫсЭЃЌетЪЧвђЮЊЮоЫЎСђЫсЭКЭЫЎЗДгІЩњГЩРЖЩЋЙЬЬхЮхЫЎСђЫсЭЃЌПЩвдМьбщЫЎЕФДцдкЃЌЙЪЬюЮоЫЎСђЫсЭЁЃ
ЃЈ2ЃЉCu2ЃЈOHЃЉ2CO3дкМгШШЕФЬѕМўЯТЗжНтЩњГЩбѕЛЏЭЁЂЫЎКЭЖўбѕЛЏЬМЃЌЙЪЗДгІЕФЛЏбЇЗНГЬЪНаДЮЊЃКCu2ЃЈOHЃЉ2CO3![]() 2CuO+H2O+CO2ЁќЁЃ
2CuO+H2O+CO2ЁќЁЃ
ЃЈ3ЃЉЪЕбщЙ§ГЬжаЃЌЗЂЯжAжаТЬЩЋЙЬЬхж№НЅБфЮЊКкЩЋЃЌBжаЙЬЬхБфРЖЩЋЃЌCжаЯжЯѓЮЊГЮЧхЪЏЛвЫЎБфЛызЧЃЌЙЪЬюГЮЧхЪЏЛвЫЎБфЛызЧЃЛ
CжаЕФЗДгІЪЧЖўбѕЛЏЬМКЭЧтбѕЛЏИЦЗДгІЩњГЩАзЩЋГСЕэЬМЫсИЦКЭЫЎЃЌЙЪЗДгІЕФЛЏбЇЗНГЬЪНаДЮЊЃКCaЃЈOHЃЉ2+CO2ЈTCaCO3Ё§+H2OЁЃ
ЃЈ4ЃЉЂкШчгаСђЫсЭДцдкЃЌдђСђЫсЭгыТШЛЏБЕЗДгІЩњГЩТШЛЏЭКЭСђЫсБЕЕФАзЩЋГСЕэЃЌЙЪЬюАзЩЋГСЕэЃЛ
ЂлМьбщТШЛЏЭДцдкПЩЭЈЙ§МьбщCl-РДбщжЄЃЌТШРызггывѕРызгНсКЯЩњГЩТШЛЏвјЕФАзЩЋГСЕэЃЌЫљвдПЩвдМгШыЯѕЫсвјШмвКЃЌЙЪЬюЯѕЫсвјШмвКЁЃ
ЃЈЮхЃЉЃЈ1ЃЉвдбѕЛЏЮяЕФаЮЪНБэЪОCu2ЃЈOHЃЉ2CO3ЕФзщГЩЮЊ2CuOH2OCO2ЃЌЙЪЬю2CuOH2OCO2ЃЛ
НтЃКЩшЯћКФСђЫсжЪСПЮЊx
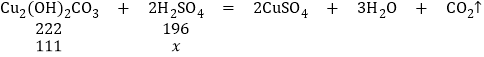
222ЃК196=111ЃКx
xЃН98g
ЙЪЬю98ЁЃ
ЃЈ2ЃЉЂй АБЗжзгИіЪ§КЭяЇИљИіЪ§ЯрЕШЃЌСђЫсИљИіЪ§КЭСђЫсБЕИіЪ§ЯрЕШЃЌЩњГЩАБЦјжЪСПЪЧ0.0425gЃЌЩњГЩСђЫсБЕжЪСПЪЧ1.165gЃЌЛЦяЇЬњЗЏжаNH4+гыSO42ЉЕФИіЪ§БШЮЊЃК![]() ЃК
ЃК![]() ЃН1ЃК2ЃЌЙЪЬю1ЃК2ЁЃ
ЃН1ЃК2ЃЌЙЪЬю1ЃК2ЁЃ
Ђк ЕУЕНКьзиЩЋЗлФЉ0.600gЃЌМДЕУЕН0.600gбѕЛЏЬњЃЌЦфжаЬњдЊЫижЪСПЮЊЃК0.600gЁС![]() ЃН0.42gЃЌЬњРызгЯрЖдИіЪ§ЃК
ЃН0.42gЃЌЬњРызгЯрЖдИіЪ§ЃК![]() ЃЛАБИљРызгЯрЖдИіЪ§ЃК
ЃЛАБИљРызгЯрЖдИіЪ§ЃК![]() ЃН0.0025ЃЌСђЫсИљРызгИіЪ§ЃК
ЃН0.0025ЃЌСђЫсИљРызгИіЪ§ЃК![]() ЃН0.005ЃЌЩшЧтбѕИљРызгЯрЖдИіЪ§ЮЊaЃЌИљОнЬтвтгаЃК0.0025ЁСЃЈ+1ЃЉ+0.0075ЁСЃЈ+3ЃЉ+0.005ЁСЃЈЉ2ЃЉ+aЁСЃЈЉ1ЃЉЃН0ЃЌдђaЃН0.015ЃЌЫљвдxЃКyЃКmЃКnЃН0.0025ЃК0.0075ЃК0.005ЃК0.015ЃН1ЃК3ЃК2ЃК6ЃЌвђДЫЛЦяЇЬњЗЏЕФЛЏбЇЪН NH4Fe3ЃЈSO4ЃЉ2ЃЈ/span>OHЃЉ6ЃЌЙЪЬюNH4Fe3ЃЈSO4ЃЉ2ЃЈOHЃЉ6ЁЃ
ЃН0.005ЃЌЩшЧтбѕИљРызгЯрЖдИіЪ§ЮЊaЃЌИљОнЬтвтгаЃК0.0025ЁСЃЈ+1ЃЉ+0.0075ЁСЃЈ+3ЃЉ+0.005ЁСЃЈЉ2ЃЉ+aЁСЃЈЉ1ЃЉЃН0ЃЌдђaЃН0.015ЃЌЫљвдxЃКyЃКmЃКnЃН0.0025ЃК0.0075ЃК0.005ЃК0.015ЃН1ЃК3ЃК2ЃК6ЃЌвђДЫЛЦяЇЬњЗЏЕФЛЏбЇЪН NH4Fe3ЃЈSO4ЃЉ2ЃЈ/span>OHЃЉ6ЃЌЙЪЬюNH4Fe3ЃЈSO4ЃЉ2ЃЈOHЃЉ6ЁЃ

ЁОЬтФПЁПЯТСаЙлЕуЖМЪЧДэЮѓЕФЃЌЧыФугУЛЏбЇЗНГЬЪНМгвдЫЕУїЃК
ЙлЕу | ЛЏбЇЗНГЬЪН |
ЂйбѕЛЏЗДгІвЛЖЈЪЧЛЏКЯЗДгІ | _____ |
ЂкгабЮКЭЫЎЩњГЩЗДгІвЛЖЈЪЧжаКЭЗДгІ | _____ |
ЂлжУЛЛЗДгІвЛЖЈгаН№ЪєЩњГЩ | _____ |
ЂмМюКЭбЮЗДгІВЛПЩФмЭЌЪБВњЩњСНжжГСЕэ | _____ |
ЁОЬтФПЁП20ЁцЪБЃЌNaClШмНтЧщПіМћЯТБэЃЌЯрЙиа№Ъіе§ШЗЕФЪЧ
ЪЕбщ ађКХ | ЫЎЕФ жЪСП(g) | МгШыNaCl ЕФжЪСП(g) | ШмвКЕФ жЪСП(g) |
Ђй | 10.0 | 1.5 | 11.5 |
Ђк | 10.0 | 3.0 | 13.0 |
Ђл | 10.0 | 4.5 | 13.6 |
Ђм | 10.0 | 6.0 | 13.6 |
A. ЂйЫљЕУШмвКЕФШмжЪжЪСПЗжЪ§ЮЊ15.0ЃЅ
B. ЂкжаЫљЕУШмвКЪЧБЅКЭШмвК
C. 20ЁцЪБЃЌNaCl ЕФШмНтЖШЪЧ45.0gЃЏ100g ЫЎ
D. ЂлЂмШмвКЕФШмжЪжЪСПЗжЪ§ЯрЕШ