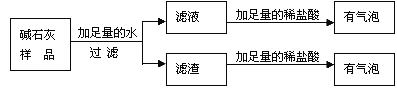
题目内容
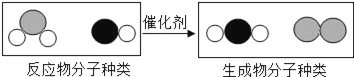
【题目】如图所示的两个实验能验证水的组 成.

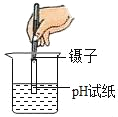
(1)图 1 所示实验中,观察到的现象是__________.
(2)图 2 所示实验,接通直流电源一段时间后,玻璃管 b 内产生的气体是_______________ ,该管内产生约 10mL气体时,玻璃管 a 内产生约___________mL 气体.
(3)上述实验说明水是由_______________ 组成的.
(4)电解水的实验中,在电解器玻璃管里加满含有酚酞的硫酸钠溶液(硫酸钠只增强导电性,不发生反应)。在实验过程中,观察到管 b 电极附近的溶液迅速变红,则该处溶液 呈_____(填“酸”“碱”或“中”)性。电解后,待溶液混合均匀后测得溶液的 pH=7,说明电解时管 a 电极附近的溶液呈______(填“酸”“碱”或“中”)性.
(5)若取 36g 质量分数为 1%的硫酸钠溶液进行电解,若电解后硫酸钠溶液中溶质的质 量分数变为 1.8%,则消耗了________g 水。
(6)为除去水中的颜色和异味向水中加入______, 该过程属于______(填“物 理”或“化学”)变化。
(7)生活中可以通过煮沸方法来降低水的硬度,硬水在煮沸过程中发生的化学反应之一 是:碳酸氢钙→碳酸钙+二氧化碳+水,该反应属于反应类型中的______(填反应类 型);生活中可用______区分硬水和软水。
【答案】 H2 燃烧产生淡蓝色火焰,烧杯内壁出现水雾 O2 20 氢元素和氧元素 碱 酸 16 活性炭 物理 分解反应 肥皂水
【解析】(1)根据氢气在空气中燃烧的现象解答;(2)根据电解水的实验结论(负氢正氧 氧一氢二)分析解答;(3)根据电解水的结论解答;(4)根据酚酞溶液遇碱性溶液变红解答;根据溶液pH由大于7变为等于7分析解答;(5)根据反应前后溶质质量不变计算解答;(6)根据活性炭有吸附性解答;(7)根据反应的特点及生活中用肥皂水区分硬水和软水解答。(1)氢气在空气中燃烧,观察到的现象是H2 燃烧产生淡蓝色火焰,烧杯内壁出现水雾;(2)图 2 所示实验,接通直流电源一段时间后,b管接电源正极,所以玻璃管 b 内产生的气体是O2,该管内产生约 10mL气体时,玻璃管 a 内产生约20mL 气体;(3)上述实验说明水是由氢元素和氧元素组成的;(4) 由于酚酞溶液遇碱性溶液变红,故b 电极附近的溶液呈碱性;电解后,待溶液混合均匀后测得溶液的 pH=7,说明电解时管 a 电极附近的溶液呈酸性;(5)设消耗水的质量为x。则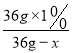 =1.8%,x=16g;(6)为除去水中的颜色和异味向水中加入活性炭,该过程属于物理变化;(7)该反应符合“一变多”的形式,所以分解反应;生活中可用肥皂水区分硬水和软水。
=1.8%,x=16g;(6)为除去水中的颜色和异味向水中加入活性炭,该过程属于物理变化;(7)该反应符合“一变多”的形式,所以分解反应;生活中可用肥皂水区分硬水和软水。

 名校课堂系列答案
名校课堂系列答案【题目】人类发展的历史进程中人们不断研制出各种不同的用具,制造用具的材料也在不断地发生变化,金属制品因其美观、耐用、轻便易成型而被人们广泛利用,请根据所学知识及生活知识参与有关金属制品探究。
(一)以下工具的制作过程中没有发生化学变化的是_____。
A原始人制作石刀 B冶炼青铜 C炼铁
(二)请将以下金属材料的冶炼按年代的先后顺序排序_____(填序号)。
A铁 B青铜 C铝
从以上顺序可以看出,金属制品的出现顺序与_____有关,那么金属钾的制得应排在_____(填序号)之后。
(三)铜器是生活中常见物品,铜器保存不善,表面会生成一层绿色铜锈Cu2(OH) 2CO3.铜生锈的条件除了水和氧气外还需要_____(写化学式)。
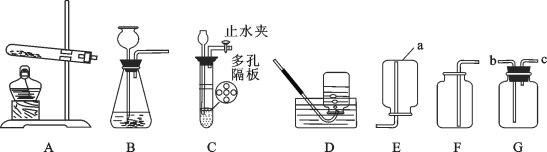
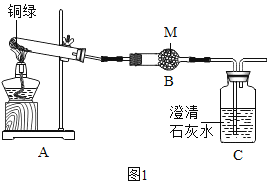
(四)为了探究碱式碳酸铜的化学性质和组成,该小组同学取少量铜绿(假设杂质不参与反应)按如图装置进行实验:
已知:I.铜绿的主要成分是碱式碳酸铜。
Ⅱ.铜器因所处环境不同,生成的铜绿中可能还含有CuSO4和CuCl2。
Ⅲ.硫酸铜、氯化铜的化学性质稳定,酒精灯加热条件下不分解。
(1)M药品的名称是_____。
(2)写出Cu2(OH)2CO3分解的化学方程式_____。
(3)实验过程中,发现A中绿色固体逐渐变为黑色,B中固体变蓝色,C中现象为_____,此处发生反应的化学方程式为_____。
(4)为了验证铜绿中是否有CuSO4和CuCl2,该小组同学进行了如下实验,请补充完成下列实验报告:
步骤 | 操作 | 现象及结论 |
① | 取少量铜绿溶于足量稀硝酸中,并将溶液分成甲、乙两份 | 产生气泡 |
② | 向甲中滴加硝酸钡溶液 | 若观察到_____,则铜绿中含有CuSO4 |
③ | 向乙中加入过量的硝酸钡溶液,振荡、静置,取上层清液于试管中,再滴加_____。 | 若观察到产生白色沉淀,则铜绿中含有CuCl2 |
(五)已知:
①铜矿矿石中含有Cu2(OH)2CO3及含铁元素的杂质;
②黄铵铁矾的化学式为 (NH4)xFey(SO4)m(OH)n,其中铁为+3价。
③在化学中Fe3O4可以表示为FeOFe2O3
某兴趣小组利用该铜矿石制黄铵铁矾的流程如图2:
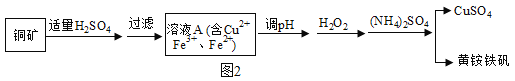
(1)以氧化物的形式表示Cu2(OH)2CO3的组成为_____,111gCu2 (OH)2CO3与稀H2SO4反应时消耗H2SO4的质量为_____g。
(2)该小组为测定黄铵铁矾的组成,进行了如下实验:
a.称取mg样品,加盐酸完全溶解后,将所得溶液分为两等份;
b.向一份中加入足量NaOH溶液并加热,收集到0.0425g的气体(假设气体全部逸出)。将所得沉淀过滤、洗涤、灼烧至恒重,得到红棕色粉末0.600g。
c.向另一份中加足量BaCl2溶液充分反应后,过滤、洗涤、干燥得沉淀1.165g。
①黄铵铁矾中NH4+与SO42﹣的个数比为_____。
②通过计算确定黄铵铁矾的化学式_____。(写出计算过程)
【题目】实验室有一包固体药品,可能含有BaSO4、Na2CO3、CuSO4、NaCl、CaCl2、NaOH中的一种或几种,为确定其成分,某班同学在老师的指导下进行探究。
(一)定性探究:
Ⅰ.称取少量样品,加入足量水中充分溶解,过滤后得到白色沉淀和无色滤液。由实验现象可知,原固体中一定不含____;
Ⅱ.取Ⅰ中得到的滤液少量,设计实验继续探究原固体的成分,请帮他们完成实验报告并回答问题。
操作 | 现象 | 结论 |
向滤液中加入足量氯化钙溶液 | 产生白色沉淀 | 原固体中一定含有____ |
取上层清液,滴加____ | ____ | 原固体中不含NaOH |
其中,步骤加入足量氯化钙溶液的目的除了检验一定含有的物质外,还能起到的作用是____;
Ⅲ.再取Ⅰ中得到的滤液少量,进行如下操作:
![]()
同学们认为:原固体中一定含有NaCl。但是老师指出这个结论不正确,其理由是___(填序号)
A.滤液中含有Na2CO3,也能和AgNO3反应生成沉淀
B.滤液中的NaCl可能是由原固体中的Na2CO3和CaCl2反应生成
(二)定量探究:
在老师的指导下同学们又精确称量了10g原固体,进行如下实验:
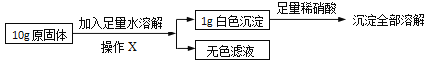
同学们认为,根据“沉淀全部溶解”的现象可确定白色沉淀的成分是____,则原固体中一定不含____;其中,操作X的名称是____,无色滤液中一定含有的阳离子是____。
试根据生成沉淀的质量计算原固体中氯化钙的质量分数,写出计算过程_____。