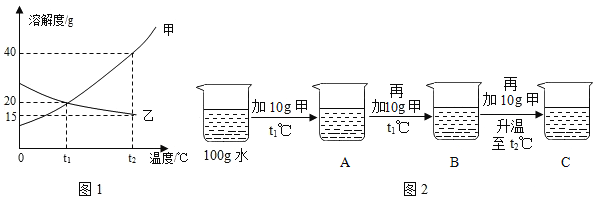
题目内容
【题目】自来水消毒过程中通常会发生如下化学反应,其反应的微观过程可用图表示:

(![]() 表示氯原子,
表示氯原子,![]() 表示氧原子,
表示氧原子,![]() 表示氢原子)
表示氢原子)
(1)请写出甲图所示反应的化学方程式 ;
(2)乙图所示反应的基本反应类型为 ;
(3)上述物质中,属于单质的有 (填化学式);
(4)D物质中氯元素的化合价为 ;
(5)以甲图为例分析,你能总结出的一条结论是 .
【答案】(1)H2O+Cl2═HCl+HCl(2)分解反应.(3)Cl2、O2(4)+1价 (5)化学反应前后原子的种类、数目不变(或化学反应前后元素的种类不变、化学反应的本质是原子的重新组合等合理说法均给分).
【解析】
试题(1)由图中可知,水和氯气反应生成次氯酸和盐酸,反应的化学方程式为:H2O+Cl2═HCl+HCl(2)反应物是一种,生成物是两种,属于分解反应.故填:分解反应.(3)氯气和氧气都是由同种元素组成的纯净物,属于单质.故填:Cl2、O2(4)氢元素是+1价,氧元素是﹣2价,可以求出氯元素的化合价是+1价.故填:+1价 (5)在化学变化中,原子是最小的微粒.故填:化学反应前后原子的种类、数目不变(或化学反应前后元素的种类不变、化学反应的本质是原子的重新组合等合理说法均给分).

【题目】碲(Te)被誉为“现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁”。实验室模拟提取碲的一个实验是:取某含碲溶液于烧瓶中,加入适量NaCl,加热到一定温度,持续通入SO2,待反应一段时间,过滤得到粗碲。
(1)反应的总化学方程式为: ![]() ,则X为______(填化学式);
,则X为______(填化学式);
(2)为探究获得较高粗碲沉淀率的反应条件,某研究小组在控制NaCl浓度和SO2流量不变的条件下,进行下述对比试验,数据如下:
实验 | 温度/℃ | 反应时间/h | 粗碲沉淀率/% |
a | 65 | 3.0 | 65.0 |
b | 80 | 3.0 | 98.9 |
c | 80 | 2.0 | 98.9 |
d | 90 | 2.0 | 97.0 |
①该小组研究的反应条件是______和______;
②实验a和b 的目的是______;
③为了提升设备利用效率和节约能源,可进一步优化反应条件测定粗碲沉淀率。若再设计对比实验,选择的反应条件还可以是______(填序号)。
A 80℃,1.5h B 80℃,2.5h C 70℃,2.0h D 95℃, 2.0h
【题目】人类发展的历史进程中人们不断研制出各种不同的用具,制造用具的材料也在不断地发生变化,金属制品因其美观、耐用、轻便易成型而被人们广泛利用,请根据所学知识及生活知识参与有关金属制品探究。
(一)以下工具的制作过程中没有发生化学变化的是_____。
A原始人制作石刀 B冶炼青铜 C炼铁
(二)请将以下金属材料的冶炼按年代的先后顺序排序_____(填序号)。
A铁 B青铜 C铝
从以上顺序可以看出,金属制品的出现顺序与_____有关,那么金属钾的制得应排在_____(填序号)之后。
(三)铜器是生活中常见物品,铜器保存不善,表面会生成一层绿色铜锈Cu2(OH) 2CO3.铜生锈的条件除了水和氧气外还需要_____(写化学式)。
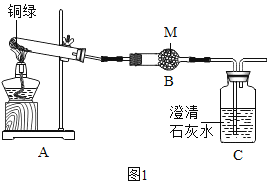
(四)为了探究碱式碳酸铜的化学性质和组成,该小组同学取少量铜绿(假设杂质不参与反应)按如图装置进行实验:
已知:I.铜绿的主要成分是碱式碳酸铜。
Ⅱ.铜器因所处环境不同,生成的铜绿中可能还含有CuSO4和CuCl2。
Ⅲ.硫酸铜、氯化铜的化学性质稳定,酒精灯加热条件下不分解。
(1)M药品的名称是_____。
(2)写出Cu2(OH)2CO3分解的化学方程式_____。
(3)实验过程中,发现A中绿色固体逐渐变为黑色,B中固体变蓝色,C中现象为_____,此处发生反应的化学方程式为_____。
(4)为了验证铜绿中是否有CuSO4和CuCl2,该小组同学进行了如下实验,请补充完成下列实验报告:
步骤 | 操作 | 现象及结论 |
① | 取少量铜绿溶于足量稀硝酸中,并将溶液分成甲、乙两份 | 产生气泡 |
② | 向甲中滴加硝酸钡溶液 | 若观察到_____,则铜绿中含有CuSO4 |
③ | 向乙中加入过量的硝酸钡溶液,振荡、静置,取上层清液于试管中,再滴加_____。 | 若观察到产生白色沉淀,则铜绿中含有CuCl2 |
(五)已知:
①铜矿矿石中含有Cu2(OH)2CO3及含铁元素的杂质;
②黄铵铁矾的化学式为 (NH4)xFey(SO4)m(OH)n,其中铁为+3价。
③在化学中Fe3O4可以表示为FeOFe2O3
某兴趣小组利用该铜矿石制黄铵铁矾的流程如图2:
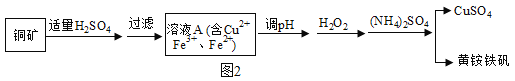
(1)以氧化物的形式表示Cu2(OH)2CO3的组成为_____,111gCu2 (OH)2CO3与稀H2SO4反应时消耗H2SO4的质量为_____g。
(2)该小组为测定黄铵铁矾的组成,进行了如下实验:
a.称取mg样品,加盐酸完全溶解后,将所得溶液分为两等份;
b.向一份中加入足量NaOH溶液并加热,收集到0.0425g的气体(假设气体全部逸出)。将所得沉淀过滤、洗涤、灼烧至恒重,得到红棕色粉末0.600g。
c.向另一份中加足量BaCl2溶液充分反应后,过滤、洗涤、干燥得沉淀1.165g。
①黄铵铁矾中NH4+与SO42﹣的个数比为_____。
②通过计算确定黄铵铁矾的化学式_____。(写出计算过程)