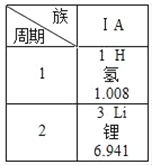
题目内容
【题目】从化学反应的微观示意图中获得的错误信息是 ( )
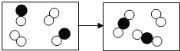
A. 该图表示的是一个化合反应
B. 该化学反应中,一定有元素的化合价发生改变
C. 化学反应前后,原子种类、数目保持不变
D. 该反应中反应物和生成物都是由原子直接构成的物质
【答案】D
【解析】
A、由物质的微观构成可以知道,两个![]() 分子和一个
分子和一个![]() 分子反应生成两个
分子反应生成两个![]() 分子,符合多变一的特征,属于化合反应;说法正确;故不符合题意;
分子,符合多变一的特征,属于化合反应;说法正确;故不符合题意;
B、由化学反应的微观模拟示意图可以知道,分子的种类发生了变化,由单质变成了化合物,化合价一定发生了变化,说法正确;故不符合题意;
C、由反应前后微粒的变化可以知道,化学反应中原子种类和数目没有发生改变,说法正确,故不符合题意;
D、该反应中反应物和生成物都是由分子直接构成的物质,说法错误;故符合题意;
故选D

【题目】在小英家的仓库里,堆放着一袋袋化肥——碳酸氢铵(NH4HCO3)。过了一个夏天,小英发现这种化肥所持有的刺激性气味变得更浓烈了,有些化肥袋里碳酸氢铵变少了,检查发现变少的化肥包装袋没有密封,化肥没有撒落在地上,也没有人进过仓库打开使用。为了探究这些化肥减少的原因,小英在实验室取了一些碳酸氢铵粉末,放在蒸发皿中加热,过一会儿观察到粉末完全消失,同时也闻到了这种刺激性气味。粉末为什么会消失呢?
(提出问题)碳酸氢铵粉末消失的原因是什么?
(猜想)①碳酸氢铵粉末在不加热或加热条件下由固态变成它的气态。
②碳酸氢铵在不加热或加热条件下发生分解反应,可能产生的物质有氨气和一些氧化物。
(查阅资料)①碳酸氢铵属于氮肥,不具有升华的性质,说明上述猜想_____(填序号)不成立;②氨气(化学式NH3)具有特殊的刺激性气味,极易溶于水,其水溶液呈碱性,但干燥的氨气不能使干燥的红色石蕊试纸变蓝;③NO2为红棕色气体。NO为无色气体,在空气中易发生反应:2NO+O2===2NO2 。
(实验操作,现象与结论)
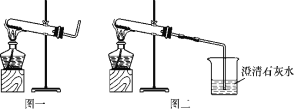
实验操作 | 实验现象 | 实验结论 |
①取适量碳酸氢铵于试管中加热,如图一所示,将干燥的红色石蕊试纸接近导管口 | 产生强烈的刺激性气味,试管壁上有无色液滴且试纸变蓝,但未见红棕色气体 | 分解产物中有____和__,没有________________。 |
②按如图二所示装置继续实验,直到反应完全 | 澄清石灰水变浑浊 | 分解产物有___________。 |
(拓展应用)
①请写出碳酸氢铵发生分解反应的化学方程式____________。
②写出图二中澄清石灰水变浑浊的化学方程式_____________。
③判断:碳酸氢铵是否可用于实验室制取氨气?_______说明理由
④如果你家里有碳酸氢铵化肥,你应该如何保存?______________________。
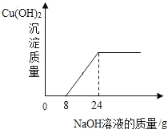
【题目】碲(Te)被誉为“现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁”。实验室模拟提取碲的一个实验是:取某含碲溶液于烧瓶中,加入适量NaCl,加热到一定温度,持续通入SO2,待反应一段时间,过滤得到粗碲。
(1)反应的总化学方程式为: ![]() ,则X为______(填化学式);
,则X为______(填化学式);
(2)为探究获得较高粗碲沉淀率的反应条件,某研究小组在控制NaCl浓度和SO2流量不变的条件下,进行下述对比试验,数据如下:
实验 | 温度/℃ | 反应时间/h | 粗碲沉淀率/% |
a | 65 | 3.0 | 65.0 |
b | 80 | 3.0 | 98.9 |
c | 80 | 2.0 | 98.9 |
d | 90 | 2.0 | 97.0 |
①该小组研究的反应条件是______和______;
②实验a和b 的目的是______;
③为了提升设备利用效率和节约能源,可进一步优化反应条件测定粗碲沉淀率。若再设计对比实验,选择的反应条件还可以是______(填序号)。
A 80℃,1.5h B 80℃,2.5h C 70℃,2.0h D 95℃, 2.0h
【题目】人类发展的历史进程中人们不断研制出各种不同的用具,制造用具的材料也在不断地发生变化,金属制品因其美观、耐用、轻便易成型而被人们广泛利用,请根据所学知识及生活知识参与有关金属制品探究。
(一)以下工具的制作过程中没有发生化学变化的是_____。
A原始人制作石刀 B冶炼青铜 C炼铁
(二)请将以下金属材料的冶炼按年代的先后顺序排序_____(填序号)。
A铁 B青铜 C铝
从以上顺序可以看出,金属制品的出现顺序与_____有关,那么金属钾的制得应排在_____(填序号)之后。
(三)铜器是生活中常见物品,铜器保存不善,表面会生成一层绿色铜锈Cu2(OH) 2CO3.铜生锈的条件除了水和氧气外还需要_____(写化学式)。
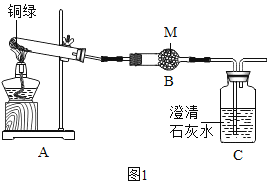
(四)为了探究碱式碳酸铜的化学性质和组成,该小组同学取少量铜绿(假设杂质不参与反应)按如图装置进行实验:
已知:I.铜绿的主要成分是碱式碳酸铜。
Ⅱ.铜器因所处环境不同,生成的铜绿中可能还含有CuSO4和CuCl2。
Ⅲ.硫酸铜、氯化铜的化学性质稳定,酒精灯加热条件下不分解。
(1)M药品的名称是_____。
(2)写出Cu2(OH)2CO3分解的化学方程式_____。
(3)实验过程中,发现A中绿色固体逐渐变为黑色,B中固体变蓝色,C中现象为_____,此处发生反应的化学方程式为_____。
(4)为了验证铜绿中是否有CuSO4和CuCl2,该小组同学进行了如下实验,请补充完成下列实验报告:
步骤 | 操作 | 现象及结论 |
① | 取少量铜绿溶于足量稀硝酸中,并将溶液分成甲、乙两份 | 产生气泡 |
② | 向甲中滴加硝酸钡溶液 | 若观察到_____,则铜绿中含有CuSO4 |
③ | 向乙中加入过量的硝酸钡溶液,振荡、静置,取上层清液于试管中,再滴加_____。 | 若观察到产生白色沉淀,则铜绿中含有CuCl2 |
(五)已知:
①铜矿矿石中含有Cu2(OH)2CO3及含铁元素的杂质;
②黄铵铁矾的化学式为 (NH4)xFey(SO4)m(OH)n,其中铁为+3价。
③在化学中Fe3O4可以表示为FeOFe2O3
某兴趣小组利用该铜矿石制黄铵铁矾的流程如图2:
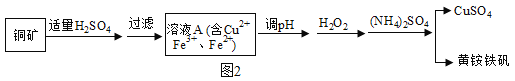
(1)以氧化物的形式表示Cu2(OH)2CO3的组成为_____,111gCu2 (OH)2CO3与稀H2SO4反应时消耗H2SO4的质量为_____g。
(2)该小组为测定黄铵铁矾的组成,进行了如下实验:
a.称取mg样品,加盐酸完全溶解后,将所得溶液分为两等份;
b.向一份中加入足量NaOH溶液并加热,收集到0.0425g的气体(假设气体全部逸出)。将所得沉淀过滤、洗涤、灼烧至恒重,得到红棕色粉末0.600g。
c.向另一份中加足量BaCl2溶液充分反应后,过滤、洗涤、干燥得沉淀1.165g。
①黄铵铁矾中NH4+与SO42﹣的个数比为_____。
②通过计算确定黄铵铁矾的化学式_____。(写出计算过程)