��Ŀ����
����Ŀ���������һ�ֲ��Ƽ���ij��ȤС�������۵���Ҫ�ɷּ��京��չ����һϵ��̽����
��ʵ��̽��һ����1������۵���Ҫ�ɷ���ʲô��
ʵ�� | ʵ����� | ʵ������ |
����һ | ȡ������Ʒ���Թ��У���������_____ | ������ɫ���� |
����� | ������һ����������ͨ�����ʯ��ˮ | ������ɫ���� |
��д��������з�����Ӧ�Ļ�ѧ����ʽ_____��
��ʵ����ۣ�����۵���Ҫ�ɷ�Ϊ̼��ơ�
��ʵ��̽�������ⶨ�������̼��Ƶ����������������ʲ���ϡ���ᷴӦ��
������һ����2������ȤС���ͬѧ������ͼ1��ʾװ�ý���ʵ��̽�����Ƶ��ձ�������Ϊ40.03g���Ƶ��������Ʒ������Ϊ12g������������ϡ��������Ϊ200g����ȫ��Ӧ������ƽ��ʾ��Ϊ247.63g����������������̼��Ƶ���������______����д�����㲽�裺������������0.1%��
������������3������ȤС���ͬѧ��Ϊͼ2��ʾװ��Ҳ�ɲⶨ�������̼��Ƶ�������������Ҫ�ⶨ����������Ʒ��������_____�����������û��װ��B����ʹ��õ�̼��Ƶ���������_____��������ƫ��������ƫС����������������
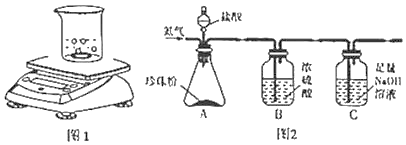
���𰸡�ϡ���� Ca��OH��2+CO2��CaCO3��+H2O 83.3% װ��C ƫ��
��������
�⣺��1��̼���κ��ᷴӦ�����ɶ�����̼��������̼���������Ʒ�Ӧ������̼��Ƴ���������
ʵ�� | ʵ����� | ʵ������ |
����һ | ȡ������Ʒ���Թ��У���������ϡ���� | ������ɫ���� |
����� | ������һ����������ͨ�����ʯ��ˮ | ������ɫ���� |
�ڲ�����з�����Ӧ�Ļ�ѧ����ʽ�ǣ�Ca��OH��2+CO2��CaCO3��+H2O��
��2�����ɶ�����̼������Ϊ40.03g+12g+200g��247.63g��4.4g
��μӷ�Ӧ��̼��Ƶ�����Ϊx

![]()
x��10g
����̼��Ƶ���������Ϊ��![]() ��100%��83.3%��
��100%��83.3%��
��3���������ƺͶ�����̼��Ӧ����̼���ƺ�ˮ������ͼ2��ʾװ��Ҳ�ɲⶨ�������̼��Ƶ�������������Ҫ�ⶨ����������Ʒ��������װ��C�����������û��װ��B��������̼Я����ˮ�����������̼��������������Һ�У���������������Һ���ӵ�����ƫ�����Ի�ʹ��õ�̼��Ƶ���������ƫ��

 ��������ܸ�ϰϵ�д�
��������ܸ�ϰϵ�д�����Ŀ�����A��B��������ѡһ����������������𣬰�A�Ʒ֡�
A ʵ���������� | B ʵ�����ƶ�����̼ |
���������ȡ�����Ļ�ѧ����ʽ��____��ѡ�õķ���װ��Ϊ_______�� | ʵ������ȡCO2�Ļ�ѧ����ʽ��______��ѡ�õķ���װ��Ϊ_______�� |
�ɹ�ѡ���ʵ��װ�ã�
| |
����Ŀ��ij��ѧ��ȤС����ʵ����������غͶ������̻�ϼ�����ȡ����ʱ�������Ƶõ������д̼�����ζ����������ʦ��ָ���¶Ը�����ɷֽ���̽����
��������⣩����غͶ������̻�ϼ��Ⱥ����������ɷ���ʲô��
���������ϣ�![]() ����غͶ������̻�ϼ��Ȳ���������ֻ�Ե�����ʽ���ڣ�
����غͶ������̻�ϼ��Ȳ���������ֻ�Ե�����ʽ���ڣ�
![]() ����
����![]() ���д̼�����ζ�����壬������ˮ����ʹʪ��ĵ��۵⻯����ֽ������
���д̼�����ζ�����壬������ˮ����ʹʪ��ĵ��۵⻯����ֽ������
����������裩����һ����������![]() �����������������
�����������������![]() ������������������______
������������������______
��ʵ��̽����
��� | ʵ����� | ʵ������ | ���� |
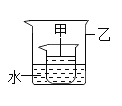
| С������ˮ���ռ�A��B��ƿ���壬��������ľ������A�У�ʪ��ĵ��۵⻯����ֽ����B�С� | A�д�����ľ����ȼ��B�е��۵⻯����ֽ����ɫ�� | ���� ______ ���� |
| С��������ſ������ռ�C��D��ƿ���壬��������ľ������C�У�ʪ��ĵ��۵⻯����ֽ����D�С� | C�д�����ľ����ȼ��D�е��۵⻯����ֽ ______ | ���������� |
����˼�����ۣ�С����ΪС���Ľ��۲���ȷ��ԭ����______
����չӦ�ã�![]() ����غͶ������̻�ϼ��ȣ������ٲ�������ʱ��ʣ�������______��______
����غͶ������̻�ϼ��ȣ������ٲ�������ʱ��ʣ�������______��______![]() �ѧʽ
�ѧʽ![]() ��
��
![]() �������̲���������������������Ӧ�����ɸ÷�Ӧ�Ļ�ѧ����ʽ��
�������̲���������������������Ӧ�����ɸ÷�Ӧ�Ļ�ѧ����ʽ��![]()
![]()
![]() ______
______![]() ��
��
����Ŀ��ˮ��������ԴȪ��Ҳ�Dz���ȱ�ٵ���Դ��
��1��ij��Ȫˮ����Ҫ�����ʳɷּ��������±���
�ɷ� | Ca | K | Zn | F |
������mg/L�� | 20 | 3 | 0.06 | 0.02 |
����Ca��K��Zn��F��ָ_____ ������ʡ�Ԫ�ء����ӻ�ԭ�ӡ�����
��2��ˮ��Ⱦ�������أ�ˮ��Դ�ı����ͺ����������ܵ����ǵ��ձ��ע����������������й����⣺
��������ˮ������ˮ����ˮ�����ڴ��������_____��
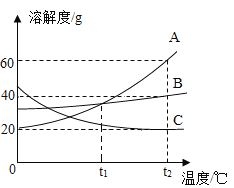
����ijѧУ��ˮ�����Խ�����ˮ����Ϊ����ˮ�����д�����������ͼ��ʾ��

�ٶ�Ӧ��������_____������ĸ��ţ���ͬ�����۶�Ӧ��������_____��
A��ɱ������ B���������� C���������� D������
�����������������ˮ����Ⱦ����_____��
A������ʹ�û��ʡ�ũҩ B����ҵ�����������ŷ� C����ֹʹ�ú���ϴ�·�
��������ȷ��ˮ������Ԫ�غ���Ԫ����ɵ�ʵ����_____��
A��ˮ������ B��ˮ�ĵ�� C��ˮ�ľ���