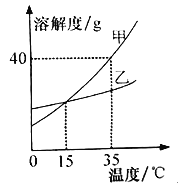
题目内容
【题目】为测定某锌铜合金中锌的含量,称取该合金样品进行如下图所示实验,发生反应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑多次实验后,所得数据(平均值)如下表:

若不考虑干燥剂吸收空气中的水蒸气,求:
(1)根据质量守恒定律,生成氢气的质量为__________g。
(2)该合金中锌的质量分数(要求写出计算过程)__________。
【答案】0.40g 81.25%
【解析】
根据质量守恒定律可知,反应前后物质的总质量不变,生成氢气的质量为342.10g+16.00g-357.70g=0.40g;
设合金中锌的质量为x
![]()
![]()
x=13.00 g
锌的质量分数=![]() ×100%
×100%![]() 81.25%
81.25%
答:(1)根据质量守恒定律,生成氢气的质量为 0.40g,
(2)该合金中锌的质量分数为81.25%。

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案【题目】珍珠粉是一种补钙剂,某兴趣小组对珍珠粉的主要成分及其含量展开了一系列探究。
(实验探究一)(1)珍珠粉的主要成分是什么?
实验 | 实验操作 | 实验现象 |
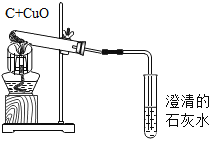
步骤一 | 取少量样品于试管中,加入足量_____ | 产生无色气泡 |
步骤二 | 将步骤一产生的气体通入澄清石灰水 | 产生白色沉淀 |
②写出步骤二中发生反应的化学方程式_____。
(实验结论)珍珠粉的主要成分为碳酸钙。
(实验探究二)测定珍珠粉中碳酸钙的质量分数。(杂质不与稀盐酸反应)
(方案一)(2)该兴趣小组的同学利用如图1所示装置进行实验探究,称得烧杯的质量为40.03g。称得珍珠粉样品的质量为12g。加入足量的稀盐酸质量为200g,完全反应后,电子天平的示数为247.63g。请你计算珍珠粉中碳酸钙的质量分数______。(写出计算步骤:计算结果保留到0.1%)
(方案二)(3)该兴趣小组的同学认为图2所示装置也可测定珍珠粉中碳酸钙的质量分数,需要测定的数据有样品的质量和_____的质量。如果没有装置B,会使测得的碳酸钙的质量分数_____。(填“偏大”、“偏小”或者“不变“)
【题目】某课外活动小组的同学为测定假黄金(铜锌合金)的组成,称取25克假黄金样品置于烧杯中,用稀硫酸80克分4次加入,实验数据记录如下.求:
实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
稀硫酸的质量/克 | 20 | 20 | 20 | 20 |
残留金属的质量/克 | 21.75 | 18.5 | 15.25 | 15.25 |
(1)假黄金与稀硫酸恰好完全反应是___________次;
(2)25克假黄金样品中锌的质量为______________克;
(3)四次实验产生气体的总质量是多少_________?(写出详细计算过程)