题目内容
【题目】根据下列装置,回答问题:
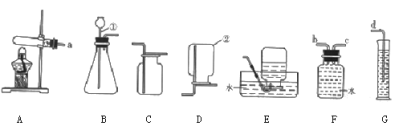
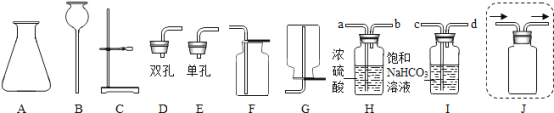
(1)写出图中标号仪器的名称:①_____,②_____。
(2)实验室用过化氢溶液和二氧化锰固体制取氧气时,发生反应的化学方程式为_____,从控制反应速率和节约药品的角度考虑,发生反应的装置最好选用_____(填装置编号)。
(3)收集氧气和二氧化碳均可以利用装置_____(填装置编号)收集,原因是_____。
(4)实验老师要把20g溶质质量分数为30%的过氧化氢溶液稀释成6%进行实验,需要加入水的质量为_____g。
【答案】锥形瓶 分液漏斗 2H2O2![]() 2H2O+O2↑ B E 氧气和二氧化碳的密度均比空气大 80
2H2O+O2↑ B E 氧气和二氧化碳的密度均比空气大 80
【解析】
解:(1)仪器①是锥形瓶,②是分液漏斗;故填:锥形瓶;分液漏斗;
(2)过氧化氢在二氧化锰的催化作用下分解为水和氧气,从控制反应速率和节约药品的角度考虑,发生反应的装置最好选用装置B来制取;故填:2H2O2![]() 2H2O+O2↑;B;
2H2O+O2↑;B;
(3)氧气和二氧化碳的密度均比空气大,所以可用向上排空气法来收集;故填:E;氧气和二氧化碳的密度均比空气大;
(4)溶液稀释过程中,溶质的质量不变,设需要加入水的质量为x,则:20g×30%=(20g+x)×6%
x=80g.故填:80。

【题目】珍珠粉是一种补钙剂,某兴趣小组对珍珠粉的主要成分及其含量展开了一系列探究。
(实验探究一)(1)珍珠粉的主要成分是什么?
实验 | 实验操作 | 实验现象 |
步骤一 | 取少量样品于试管中,加入足量_____ | 产生无色气泡 |
步骤二 | 将步骤一产生的气体通入澄清石灰水 | 产生白色沉淀 |
②写出步骤二中发生反应的化学方程式_____。
(实验结论)珍珠粉的主要成分为碳酸钙。
(实验探究二)测定珍珠粉中碳酸钙的质量分数。(杂质不与稀盐酸反应)
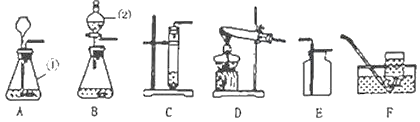
(方案一)(2)该兴趣小组的同学利用如图1所示装置进行实验探究,称得烧杯的质量为40.03g。称得珍珠粉样品的质量为12g。加入足量的稀盐酸质量为200g,完全反应后,电子天平的示数为247.63g。请你计算珍珠粉中碳酸钙的质量分数______。(写出计算步骤:计算结果保留到0.1%)
(方案二)(3)该兴趣小组的同学认为图2所示装置也可测定珍珠粉中碳酸钙的质量分数,需要测定的数据有样品的质量和_____的质量。如果没有装置B,会使测得的碳酸钙的质量分数_____。(填“偏大”、“偏小”或者“不变“)
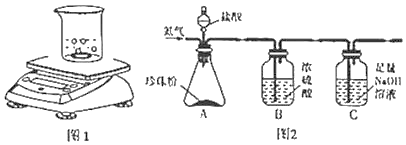
【题目】某校学生用下图1的实验验证质量守恒定律。同学们观察到镁条在空气中剧烈燃烧,发出耀眼____光,产生大量白烟弥漫到空气中,最后一些白色固体掉落在石棉网上。
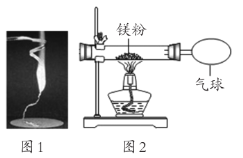
(1)同学们通过称量发现:在石棉网上收集到产物的质量小于镁条的质量。你认为出现该实验结果的原因可能是________________。
(2)小红按如图2装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
(提出问题)黄色固体是什么?
(查阅资料)①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁(![]() )固体;
)固体;
③氮化镁可与水剧烈反应产生氨气,氨气有强烈的刺激性气味。
(做出猜想)黄色固体是![]() 。
。
(实验探究)请设计实验,验证猜想
实验操作 | 实验现象 | 结论 |
__________ | __________ | 黄色固体是 |
(反思与交流)
① 写出镁条燃烧生成氮化镁的化学方程式_________________;
② 空气中![]() 的含量远大于
的含量远大于![]() 的含量,可是镁条在空气中燃烧产物
的含量,可是镁条在空气中燃烧产物![]() 却远多于
却远多于![]() ,合理的解释是 ______________;
,合理的解释是 ______________;
③ 从镁条能在氮气中燃烧、钠能在氯气中燃烧的实验事实,你对燃烧条件有了什么新的认识?请写出一种:__________。