题目内容
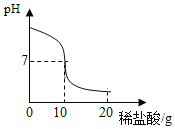
【题目】将20.0g稀盐酸逐滴加入到10.0g溶质质量分数为4.0%的氢氧化钠溶液中,边滴加边搅拌,随着稀盐酸的滴加,溶液的pH变化情况如图所示,溶液的温度变化如表所示(不考虑反应过程中热量散失)
反应时间(s) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
溶液温度(℃) | 20.5 | 20.6 | 20.7 | 20.8 | 20.9 | 20.8 | 20.7 |
(1)当稀盐酸与氢氧化钠溶液恰好完全反应时,溶液的温度是_____℃
(2)计算稀盐酸中溶质的质量分数_____(精确到0.1%)
【答案】20.9 3.7%
【解析】
(1)由表格可看出,刚开始随着反应的进行溶液的温度逐渐升高,这说明酸碱中和是放热反应,故酸碱恰好完全反应时放出的热量最多,此时溶液的温度最高。
(2)酸碱恰好完全反应时,溶液的pH等于7,此时盐酸溶液的质量为10g。氢氧化钠的质量=10.0g×4.0%=0.4g
则设盐酸溶液的溶质的质量分数为x
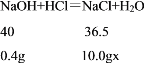
![]()
x=3.7%
答:(1)20.9
(2)稀盐酸中溶质的质量分数为3.7%

 阅读快车系列答案
阅读快车系列答案【题目】实验室制取氧气并进行相关实验:
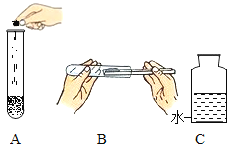
(1)用过氧化氢溶液和二氧化锰混合制氧气,下列取用二氧化锰的操作正确的是________(填字母序号)。
(2)探宄带火星的木条复燃情况,部分实验数据记录如下:
氧气体积分数(%) | 30 | 40 | 60 | 70 |
带火星的木条 | 不变 | 稍亮 | 踅燃 | 复燃 |
根据上述实验数据得出的结论是________________。
在集气瓶中注入占其容积50%的水(如图C所示),用排水法收集氧气,将瓶内的水排尽,用带火星的木条 在该集气瓶中进行实验,推测实验现象并说明理由:________________________。
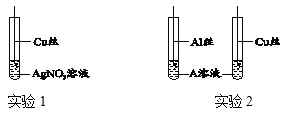
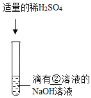
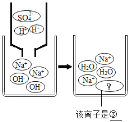
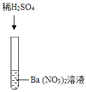
【题目】某化学兴趣小组的同学们在实验室里探究某些酸、碱、盐之间是否发生复分解反应。
(査阅资料)硫酸钡(BaSO4)白色固体,不溶于水,也不溶于盐酸、硫酸和硝酸。
(实验与探究)
内容 | 现象 | 实验解析 | 结论 | |
实验一 |
| ①_____ | 化学方程式是:K2CO3+H2SO4═K2SO4+H2O+CO2↑ | 生成物中有气体或有④___或有沉淀生成时,复分解反应可以发生。 |
实验二 |
②_____ | 溶液颜色由红色恰好变为无色 |
③_____ | |
实验三 |
| 产生白色沉淀 | 该反应的实质是:Ba2++SO42﹣═BaSO4↓ |
实验三结束后,某同学出于好奇,把实验三试管里的上层清液a倒入另一支洁净的试管中,向清液a中逐滴滴加K2CO3溶液。在滴加过程中,发现先产生气泡,然后又产生白色沉淀。根据上述现象,请你判断原清液a中的溶质是_____。
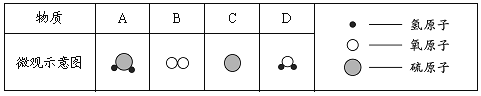
(拓展与应用)将稀盐酸Ca(OH)2溶液NaCl溶液Na2CO3溶液任意两种溶液相混合,能发生反应的共有_____组。