题目内容
某学生做了如下图所示的实验。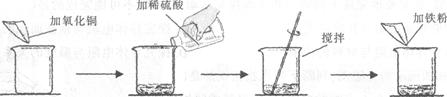
| | 第一次 | 第二次 |
| 加入氧化铜的质量 | m | m |
| 加入稀硫酸的质量 | 50g | 100g |
| 加入铁粉的质量 | 5.6g | 5.6g |
| 实验现象 | 黑色固体和紫红色固体 | 紫红色固体 |
若第二次所加物质恰好完全反应(滤液损失忽略不计),请回答下列问题:
(1)写出实验中发生反应的化学方程式
(2)第一次实验后的固体物质的化学式为
(3)根据已知条件列出求解第二次实验生成固体物质的质量(x)的比例式
(4)实验中加入氧化铜的质量(m)为 ;
(5)若向第二次反应后的滤液中加入92.8g水,则所得不饱和溶液中溶质的质量分数为 ;
(6)若用溶质质量分数为49%的硫酸溶液配制实验中所需的稀硫酸,则需要加水的质量
为 。
(1)CuO+H2SO4=CuSO4+H2O Fe+CuSO4=FeSO4+Cu;
(2)Cu0、Cu、Fe;
(3)56/64 =5.6g/X
(4)8g
(5)7.6%;
(6)80g
解析试题分析:(1)氧化铜与硫酸反应生成硫酸铜和水:CuO+H2SO4=CuSO4+H2O
铁和硫酸铜发生置换反应生成铜和硫酸亚铁:Fe+CuSO4=FeSO4+Cu;
(2)根据表格可知:第二次加入酸的质量为100g时,氧化铜完全反应,铁也是完全反应。那么第一次加入的硫酸不足,即氧化铜没有反应掉,那么铁粉过量,故第一次实验后的固体物质有氧化铜、铜、铁;
(3)第二次实验生成的固体物质是铜,利用化学方程式,根据铁的质量可求出铜的质量。
设生成铜的质量为x;
Fe+CuSO4=FeSO4+Cu
56 64
5.6g X
56/64 =5.6g/X
X=6.4g
(4)利用质量守恒定律化学反应前后元素的质量不变,反应后生成铜的质量为6.4g,设氧化铜的质量为y,则:y× 64/80 ×100% =6.4g
y=8g
(5)设生成的硫酸亚铁的质量为Z,
Fe+CuSO4=FeSO4+Cu
5.6 152
5.6g z
56/152 =5.6g/z
Z=15.2g
反应后溶液的质量=8g+100g+5.6g+92.8g-6.4g=200g
溶质的质量分数=15.2g/200g ×100%=7.6%
(6)设加入的硫酸中溶质的质量为a,
CuO+H2SO4=CuSO4+H2O
80 98
8g a
80/98 =8g/a
a=9.8g
根据溶液稀释前后溶质的质量不变,假设稀释后溶液的质量为b,
49%b=9.8g
b=20g
那么加水的质量=100g-20g=80g
考点:利用化学方程式的计算

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案为测定某生理盐水的溶质质量分数,现将生理盐水样品与足量的硝酸银溶液混合,相关实验数据如下表所示(不计损耗):
| | 反应前 | 反应后 | |
| 实验 数据 | 生理盐水样品的质量 | 加入硝酸银溶液的质量 | 过滤后剩余溶液的质量 |
| 130 g | 40 g | 167.13 g | |
(1)反应后生成氯化银固体的质量为 g。
(2)请计算该生理盐水中含氯化钠的物质的量(根据化学方程式列式计算) 。
(3) 。

 Si+2CO↑,现要制备含硅14kg的粗硅,理论上可以同时生成一氧化碳的质量是多少?
Si+2CO↑,现要制备含硅14kg的粗硅,理论上可以同时生成一氧化碳的质量是多少?