题目内容
将6.8 g含杂质的锌粒,加入到盛有50.0g过量的稀硫酸的烧杯中(杂质不溶于水,也不与稀硫酸反应),充分反应后,称得烧杯内物质的总质量为56.6 g。试计算
⑴生成氢气的质量 。
⑵锌粒中所含锌的质量分数(精确到0.1%)。(Zn-65 H-1)
(1)0.2 g (2)95.6%
解析试题分析:根据质量守恒定律化学反应前后物质的总质量不变,故减少的质量为生成的氢气的质量。利用化学方程式,利用氢气与锌反应的质量比即可求出锌的质量。
解:(1) 生成氢气的质量=6.8g+50g-56.6g=0.2g
(2)设锌粒中含锌的质量为x 。
Zn + H2SO4 = ZnSO4 + H2↑
65 2
x 0.2g 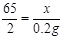
解得x =" 6.5" g
锌粒中锌的质量分数: 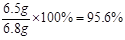
答:略
考点:利用化学方程式的计算

练习册系列答案
相关题目
某化学探究小组的同学在学校仓库里找到一块废弃的生铁暖气片,其表面有银粉漆(铝粉)涂层.该组同学取一小块生铁暖气片,用砂纸打磨除净涂层,制成生铁样品,为测定此样品中铁质量分数,他们将样品放入烧杯中,再加入足量的稀盐酸,至不再有气泡产生为止.
各步称量数据见下表:(稀盐酸的挥发可忽略不计)
| 除净涂层后的生铁样品质量/g | 11.5 |
| 烧杯的质量/g | 32.5 |
| 所加稀盐酸的质量/g | 200.0 |
| 反应后烧杯及所盛物质的总质量/g | 243.6 |
(1)反应中产生气体的质量是 g.
(2)计算该生铁样品中铁的质量分数(写出计算步骤,计算结果精确到0.1%).
(3)以下操作中,对该样品中铁的质量分数的测定结果,没有影响的是(填写序号).
A.加入的稀盐酸不足量
B.将打磨干净涂层的生铁样品磨成粉末
C.假设涂层中的铝粉已完全转化为氧化铝,且样品表面涂层未打磨干净.
某学生做了如下图所示的实验。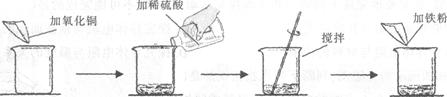
| | 第一次 | 第二次 |
| 加入氧化铜的质量 | m | m |
| 加入稀硫酸的质量 | 50g | 100g |
| 加入铁粉的质量 | 5.6g | 5.6g |
| 实验现象 | 黑色固体和紫红色固体 | 紫红色固体 |
若第二次所加物质恰好完全反应(滤液损失忽略不计),请回答下列问题:
(1)写出实验中发生反应的化学方程式
(2)第一次实验后的固体物质的化学式为
(3)根据已知条件列出求解第二次实验生成固体物质的质量(x)的比例式
(4)实验中加入氧化铜的质量(m)为 ;
(5)若向第二次反应后的滤液中加入92.8g水,则所得不饱和溶液中溶质的质量分数为 ;
(6)若用溶质质量分数为49%的硫酸溶液配制实验中所需的稀硫酸,则需要加水的质量
为 。