题目内容
为测定某生理盐水的溶质质量分数,现将生理盐水样品与足量的硝酸银溶液混合,相关实验数据如下表所示(不计损耗):
| | 反应前 | 反应后 | |
| 实验 数据 | 生理盐水样品的质量 | 加入硝酸银溶液的质量 | 过滤后剩余溶液的质量 |
| 130 g | 40 g | 167.13 g | |
(1)反应后生成氯化银固体的质量为 g。
(2)请计算该生理盐水中含氯化钠的物质的量(根据化学方程式列式计算) 。
(3) 。
(1)2.87 (2)0.02mol (3)0.9%
解析试题分析:①根据质量守恒定律,反应前后的质量应相等,所以可直接根据质量差求出生成氯化银固体质量=130g+40g-167.13g=2.87g
(2)生理盐水的溶质氯化钠会与硝酸银溶液反应,方程式为:NaCl+AgNO3→AgCl↓+NaNO3 ,根据方程式中NaCl与AgCl的物质的量的关系,先计算出AgCl物质的量=2.87g/143.5g/mol=0.02mol,
解:设生理盐水中氯化钠的物质的量是x mol
NaCl+AgNO3→AgCl↓+NaNO3
1 1
X 0.02 x =" 0.02" mol
x =" 0.02" mol
答:该生理盐水中含氯化钠的物质的量是0.02 mol。
③氯化钠的物质的量是0.02 mol,所以氯化钠的质量=0.02mol×58.5g/mol=1.17g
∴该生理盐水溶质的质量分数为=1.17g/130g×100%=0.9%
考点:质量守恒定律的应用,根据化学方程式进行的计算

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某学生做了如下图所示的实验。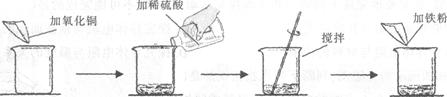
| | 第一次 | 第二次 |
| 加入氧化铜的质量 | m | m |
| 加入稀硫酸的质量 | 50g | 100g |
| 加入铁粉的质量 | 5.6g | 5.6g |
| 实验现象 | 黑色固体和紫红色固体 | 紫红色固体 |
若第二次所加物质恰好完全反应(滤液损失忽略不计),请回答下列问题:
(1)写出实验中发生反应的化学方程式
(2)第一次实验后的固体物质的化学式为
(3)根据已知条件列出求解第二次实验生成固体物质的质量(x)的比例式
(4)实验中加入氧化铜的质量(m)为 ;
(5)若向第二次反应后的滤液中加入92.8g水,则所得不饱和溶液中溶质的质量分数为 ;
(6)若用溶质质量分数为49%的硫酸溶液配制实验中所需的稀硫酸,则需要加水的质量
为 。