题目内容
下面是工厂苛化法生产烧碱的示意图。
(1)在实验室,操作Ⅰ的名称是 ;经操作Ⅰ得到废渣的主要成份是 (写化学式)。
(2)物质X中各元素的质量比表示为 。
(3)某工厂化验员向含有1.6 g氢氧化钠的溶液中,逐滴加入20.0 g盐酸至氢氧化钠和盐酸恰好完全反应。求盐酸中溶质的质量分数为多少?(写出过程)
(4)若用1.6 g上述得到的固体烧碱产品(含杂质)代替1.6 g氢氧化钠,逐滴加入上述相同浓度盐酸至反应物恰好完全反应,则消耗盐酸的质量 20 g(填“大于”、“等于”或“小于”)。
(1)过滤 CaCO3 (2)氢元素质量∶氧元素质量=1∶8 (3)7.3% (4)大于
解析试题分析:(1)在实验室,操作Ⅰ的名称是过滤,其依据是固液分离;经操作Ⅰ得到废渣的主要成份是CaCO3 ;(2)由题中的叙述可知物质X为水,故(2)物质X中各元素的质量比表示为氢元素质量∶氧元素质量=1∶8
(3)设盐酸中溶质的质量为x
NaOH + HCl="NaCl" + H2O (1分)
40 36.5
1.6 g x
40∶36.5==1.6 g ∶x
x=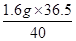 =1.46 g (1分)
=1.46 g (1分)
盐酸中溶质的质量分数为  ×100% =7.3%
×100% =7.3%
(4)若用1.6 g上述得到的固体烧碱产品(含杂质)代替1.6 g氢氧化钠,逐滴加入上述相同浓度盐酸至反应物恰好完全反应,则消耗盐酸的质量大于20g
考点:化学方程式的计算

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
某学生做了如下图所示的实验。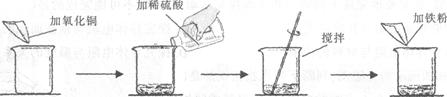
| | 第一次 | 第二次 |
| 加入氧化铜的质量 | m | m |
| 加入稀硫酸的质量 | 50g | 100g |
| 加入铁粉的质量 | 5.6g | 5.6g |
| 实验现象 | 黑色固体和紫红色固体 | 紫红色固体 |
若第二次所加物质恰好完全反应(滤液损失忽略不计),请回答下列问题:
(1)写出实验中发生反应的化学方程式
(2)第一次实验后的固体物质的化学式为
(3)根据已知条件列出求解第二次实验生成固体物质的质量(x)的比例式
(4)实验中加入氧化铜的质量(m)为 ;
(5)若向第二次反应后的滤液中加入92.8g水,则所得不饱和溶液中溶质的质量分数为 ;
(6)若用溶质质量分数为49%的硫酸溶液配制实验中所需的稀硫酸,则需要加水的质量
为 。