题目内容
【题目】(1)经过一年化学学习.你可能已经喜欢上了在实验室做实验的感觉。让我们一起再来做实验吧
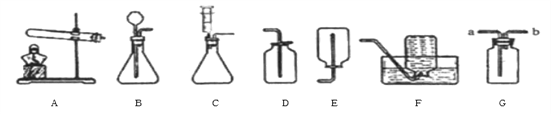
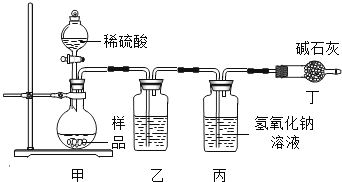
①实验室用装置A制取氧气,若要收集一瓶较纯净的氧气,应选择装置_____(填字母)若用G装置收集氧气,验满方法为_______________;
②通常情况下,乙炔是一种密度比空气略小.且难溶于水的气体。实验室常用块状碳化钙固体和水反应制取乙炔,该反应在常温下进行且非常剧烈。实验室欲制取乙炔,最好选用的装置组合是________(填字母),该发生装置的优点为__________。
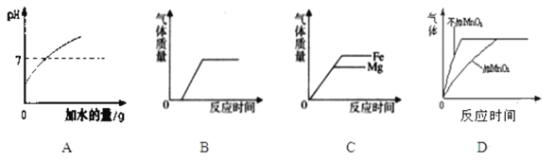
(2)化学兴趣小组同学进行中和反应实验时,将4mL2%的稀硫酸 逐滴滴加到2mL2%的氢氧化钠溶液中,测得溶液的pH变化曲线如下图所示。
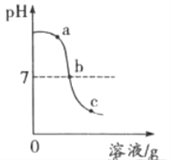
【提出问题】导致溶液pH变化的原因是什么?
【查阅资料】
①溶液的pH是由H+或OH-浓度决定,H+浓度越大,pH越小;OH-浓度越大,pH越大。
②溶液中某种离子浓度非常小时,可忽略不计。
【作出猜想】
猜想Ⅰ:溶液pH变化是因为氢氧化钠溶液被稀释。
猜想Ⅱ:溶液pH变化是因为发生了化学反应。
【进行实验】同学们分成两组分别进行实验。
甲组:同学们将4mL2%的稀硫酸换成__________,逐滴滴加到2mL2%的氢氧化钠溶液中,并测得溶液的pH始终大于7,说明猜想Ⅰ不合理。
乙组:同学们分别取a、b、c三处溶液进行实验。
实验操作 | 实验现象 | 实验分析 |
取适量a处溶液于试管中,加入镁条 | 无气泡产生 | 溶液中几乎不含___(填离子符号) |
取适量b处溶液于试管中,加入紫色石蕊溶液 | _________ | 溶液中几乎不含H+和OH- |
取适量c处溶液于试管中,加入___________ | ___________ | 溶液中几乎不含OH- |
【实验结论】猜想Ⅱ合理。
【知识拓展】从微观角度分析,中和反应的实质是_________。
【答案】 F 将带火星的木条放在b处 观察是否复燃 C F 能控制化学反应速率 4mL水(或4mL硫酸钠溶液等) H+石蕊溶液不变色 硫酸铜溶液(或氯化铁溶液等) 无沉淀产生 H+和OH-反应变成H2O(或H++OH-=H2O)
【解析】(1)因为氧气的密度比空气大,可以用向上排空气法收集,即用D装置收集,氧气不易溶于水,可以用排水法收集,即用F装置收集,用排水法收集的氧气比用排空气法收集的氧气纯净;氧气密度比空气大,则应从a端进气,短管便于排尽空气,验满的方法是将带火星的木条放于b管处,观察木条是否复燃;(2)用块状固体碳化钙与水反应制备乙炔,不需加热,属于固液常温型,注射器可逐滴滴加液体,从而可控制反应速率,制取平稳的氧气流,乙炔密度比空气略小,难溶于水,所以最好用排水法收集,实验室欲制取乙炔,最好选用的装置组合是CF;【进行实验】猜想①是溶液pH变化是因为氢氧化钠溶液被稀释,故可以改成加入4mL水;加入镁条,无气泡产生,说明不含有酸,故不含有氢离子;溶液中几乎不含有H+和OH,故加入石蕊试液不会发生颜色的变化,故填:石蕊溶液不变色;氢氧根离子能与铜离子结合产生硫酸铜沉淀,故加入硫酸铜溶液根据无沉淀产生能证明不含有氢氧根离子,故填:硫酸铜溶液;无沉淀产生;【实验拓展】中和反应的实质是H+和OH反应变成H2O。

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案【题目】小明同学对家中久置的袋装固体食品防腐剂的成分产生了兴趣(品名和成分如图所示),于是和同学一起,设计实验进行探究:

[提出问题]久置固体食品防腐剂的成分是什么?
[查阅资料]铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
[作出猜想]久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3 。
[实验探究]甲同学的探究方案如下表:
实验操作 | 实验现象 | 实验结论 |
(1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红。 | 固体中一定含有_______和氢氧化钙。此过程的化学方程式_______。 |
(2)另取少量固体放于试管中,滴加足量的稀盐酸 | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液。 | 固体中一定含有Fe ,一定不含 Fe2O3 |
(3)将步骤(2)中产生的气体通入到澄清的石灰水中 | ________ | 固体中一定含有CaCO3 |
[交流与反思]
(1)“504双吸剂”中的铁粉可以吸收空气中的_______、______。
(2)实验操作(2)的实验现象里“有大量无色气体产生”, 根据甲同学的整体探究方案推测,无色气体的成分是一定含有______,可能含有________。
(3)乙同学认为甲同学的实验中不能得出一定含Ca(OH)2的结论,理由是______。
(4)丙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是_______。