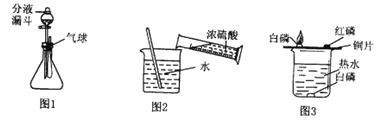题目内容
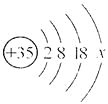
【题目】下列图像能正确反映所对应叙述关系的是
A. 向pH=2的硫酸中不断加水
B. 在久置的NaOH溶液中加盐酸
C. 分别向稀盐酸中加入等质量的Fe和Mg
D. 双氧水分解
【答案】B
【解析】A、溶液的PH<7,溶液显酸性,并且越小酸性越强;PH>7,溶液显碱性,并且越大碱性越强;PH=7,溶液显中性。pH=2的溶液显酸性,加水时酸性减弱,PH增大,PH接近7但到不了7,错误;B、久置的氢氧化钠会变质生成碳酸钠,开始加入盐酸,盐酸与氢氧化钠反应,没有气体产生,当氢氧化钠消耗尽,则碳酸钠与盐酸反应生成气体,正确;C、向稀盐酸中加入等质量铁和镁,镁的反应速率大于铁,错误;D、加二氧化锰时,双氧水分解速率较快,反应时间较短,错误。故选B。

 小夫子全能检测系列答案
小夫子全能检测系列答案【题目】暖贴的发热材料主要有铁粉、活性炭、食盐、水等物质构成。

【提出问题】发热材料中各主要物质起到了什么作业?
【猜想与假设】
Ⅰ、铁粉生锈,发生氧化反应,放出热量。
Ⅱ、活性炭能加快铁粉氧化的速率。
Ⅲ、食盐能加快铁粉氧化的速率
【进行实验】
实验编号 | 实验药品及用量 | 反应时间/min | 温度上升值/°C | ||||
铁粉/g | 活性炭/g | 食盐/g | 水/g | ||||
对照组 | 1 | 0.2 | 0.1 | 5 | 10 | 58 | |
实验组 | 1 | 0 | 0.2 | 0.1 | 5 | 10 | 0 |
2 | 1 | 0 | 0.1 | 5 | 10 | 2.7 | |
3 | 1 | 0.2 | 0.1 | 0 | 10 | 4.5 | |
4 | 1 | 0.2 | 0 | 5 | 10 | 20 | |
【解释与结论】
﹙1﹚铁生锈的条件是_________。
﹙2﹚已知铁粉在一定条件下生锈,发生氧化反应的产物可能是![]() ,该反应的化学方程式为___ 。
,该反应的化学方程式为___ 。
﹙3﹚分析________(填实验编号)的数据,可证明猜想与假设Ⅱ正确。
﹙4﹚分析实验组4与对照组的数据,可证明猜想与假设__________正确。
【反思与评价】
(5)某同学认为没有必要进行实验组Ⅰ,你是否同意他的观点并说明理由:_____________ 。
(6)某同学质疑此实验中忽略了发热材料中的水,你认为分析______________(填实 验编号)的数据,可证明水的作用。【注意:若答对以下小题奖励4分,化学试卷总分布超过60分】
【拓展】
﹙7﹚由上述实验结论分析,铁制品在海边比在内陆锈蚀得要_________(填“更快”或“更慢”)。
﹙8﹚请设计实验验证使用过后的暖贴中是否还含有单铁质:______。(写出实验操作、预期实验现象及结论)
【题目】(1)经过一年化学学习.你可能已经喜欢上了在实验室做实验的感觉。让我们一起再来做实验吧
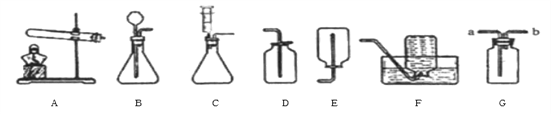
①实验室用装置A制取氧气,若要收集一瓶较纯净的氧气,应选择装置_____(填字母)若用G装置收集氧气,验满方法为_______________;
②通常情况下,乙炔是一种密度比空气略小.且难溶于水的气体。实验室常用块状碳化钙固体和水反应制取乙炔,该反应在常温下进行且非常剧烈。实验室欲制取乙炔,最好选用的装置组合是________(填字母),该发生装置的优点为__________。
(2)化学兴趣小组同学进行中和反应实验时,将4mL2%的稀硫酸 逐滴滴加到2mL2%的氢氧化钠溶液中,测得溶液的pH变化曲线如下图所示。
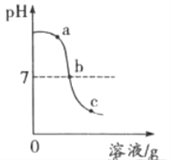
【提出问题】导致溶液pH变化的原因是什么?
【查阅资料】
①溶液的pH是由H+或OH-浓度决定,H+浓度越大,pH越小;OH-浓度越大,pH越大。
②溶液中某种离子浓度非常小时,可忽略不计。
【作出猜想】
猜想Ⅰ:溶液pH变化是因为氢氧化钠溶液被稀释。
猜想Ⅱ:溶液pH变化是因为发生了化学反应。
【进行实验】同学们分成两组分别进行实验。
甲组:同学们将4mL2%的稀硫酸换成__________,逐滴滴加到2mL2%的氢氧化钠溶液中,并测得溶液的pH始终大于7,说明猜想Ⅰ不合理。
乙组:同学们分别取a、b、c三处溶液进行实验。
实验操作 | 实验现象 | 实验分析 |
取适量a处溶液于试管中,加入镁条 | 无气泡产生 | 溶液中几乎不含___(填离子符号) |
取适量b处溶液于试管中,加入紫色石蕊溶液 | _________ | 溶液中几乎不含H+和OH- |
取适量c处溶液于试管中,加入___________ | ___________ | 溶液中几乎不含OH- |
【实验结论】猜想Ⅱ合理。
【知识拓展】从微观角度分析,中和反应的实质是_________。