题目内容
【题目】化学与科学技术、生产生活及环境保护等密切相关。
(1)我省启动保卫碧水蓝天的“263“行动,减少煤炭消费总量,减少雾霾天气的发生。形成硫酸型酸雨的主要气体是__________;严格整治畜禽养殖场污染,主要是为减少_________和P等元素及化学需氧量对水体的污染。
(2)目前正在推广用尿素水解液来消除柴油汽车尾气中的氮氧化物。写出脉素水解液中的NH3与NO在催化剂作用下,反应生成无污染物质的化学方程式____________________________________。
(3)三硅酸镁 Mg2Si3O8·nH2O具有治疗胃酸过多的作用,写出其与酸反应生成SiO2·H2O等物质的化学方程式_____________。
【答案】 SO2 N(氮) 6NO+4NH3 ![]() 5N2+6H2O Mg2Si3O8·nH2O+4HCl===2MgCl2 +3SiO2·H2O+(n-1)H2O
5N2+6H2O Mg2Si3O8·nH2O+4HCl===2MgCl2 +3SiO2·H2O+(n-1)H2O
【解析】(1)根据造成酸雨的原因以及造成水体污染的主要原因来分析;(2)(3)根据反应物、生成物、反应条件写出反应的化学方程式;(1)二氧化硫是形成硫酸型酸雨的主要气体;严格整治畜禽养殖场污染,主要是为减少氮元素与磷元素及化学需氧量对水体的污染;(2)在催化剂存在的条件下,氨气与NO反应生成无毒的N2和H2O,反应的化学方程式为4NH3+6NO![]() 5N2+6H2O;(3)三硅酸镁Mg2Si3O8·nH2O与HCl反应生成MgCl2、SiO2·H2O、H2O,反应的化学方程式为Mg2Si3O8·nH2O+4HCl=2MgCl2 +3SiO2·H2O+(n-1)H2O。
5N2+6H2O;(3)三硅酸镁Mg2Si3O8·nH2O与HCl反应生成MgCl2、SiO2·H2O、H2O,反应的化学方程式为Mg2Si3O8·nH2O+4HCl=2MgCl2 +3SiO2·H2O+(n-1)H2O。

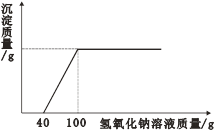
【题目】某纯碱厂生产的某批次碳酸钠产品中可能含有氯化钠杂质。
定性检验
(1)要确定该产品中是否含有杂质氯化钠,你的方法是_________________。
定量测定:
(2)若利用沉淀法测定该产品中碳酸钠的质量分数,你确定的反应原理是(用化学方程式表示)_______________________________。
(3)假设你取样的质量为m1,根据你确定的反应原理,你需要通过实验测量沉淀(填化学式)____的质量(假设你测得的沉淀的质量为m2)。
(4)请你设计实验方案,获得数据m1、m2,把方案填在下表中。
适用的仪器名称 | 实验步骤 |
____________ | ______ |
(5)数据处理:
请用含m1、m2的式子表示所测样品中碳酸钠的质量分数,______________________。
分析讨论:
(6)要测定混合物中某成分的含量,可通过化学方法将不易测定的物质转化为易测量的物质。除沉淀法外,还可依据反应(用化学方程式表示)_______________来测定该纯碱样品中碳酸钠的质量分数。