题目内容
【题目】碳、硫的含量影响钢铁性能、某兴趣小组用如下流程对钢样进行探究。
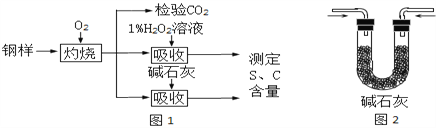
(1)钢样中硫元素以FeS形式存在,FeS在足量氧气中灼烧生成两种氧化物,其中一种是固体,固体产物中Fe、O元素的质量比为21:8,则该固体产物的化学式为_________。灼烧的反应方程式为_________;
(2)钢样灼烧生成的气体是___________和___________,检验前者需要的试剂是_______________,检验后者需要的试剂是_____________________;
(3)取10.00g钢样在足量氧气中充分灼烧,将生成的气体用适量1%的H2O2溶液充分吸收,吸收液呈现酸性,用10g0.8%的NaOH溶液恰好将吸收液中和至中性;另取10.00钢样在足量氧气中充分灼烧,将生成的气体通过盛有足量碱石灰的U型管(如图2),碱石灰增重0.614g。
①用1%H2O2溶液吸收SO2,发生化合反应,化学方程式为_________________________________;
②分别计算该钢样中硫、碳元素的质量分数(写出计算过程)_______________。
【答案】 Fe3O4,3FeS+5O2 ![]() Fe3O4+3SO2 SO2, CO2, 高锰酸钾溶液, 澄清石灰水 H2O2+SO2==H2SO4 0.32%; 1.5%
Fe3O4+3SO2 SO2, CO2, 高锰酸钾溶液, 澄清石灰水 H2O2+SO2==H2SO4 0.32%; 1.5%
【解析】(1)钢样中硫元素以FeS形式存在,FeS在足量氧气中灼烧,生成的固体产物中Fe、O两种元素的质量比为21:8,计算物质的量之比确定化学式;(2)钢样中硫元素以FeS形式存在,FeS在足量氧气中灼烧生成二氧化硫和二氧化碳,二氧化碳能使澄清石灰水变浑浊,二氧化硫能使高锰酸钾溶液褪色;(3)①过氧化氢氧与二氧化硫反应生成硫酸;②根据反应的化学方程式,结合元素守恒计算。(1)钢样中硫元素以FeS形式存在,FeS在足量氧气中灼烧,生成的固体产物中Fe、O两种元素的质量比为21:8,n(Fe):n(O)=![]() =3:4,化学式为Fe3O4;(2)钢样灼烧生成的气体是 SO2和CO2,检验前者需要的试剂是高锰酸钾溶液,检验后者需要的试剂是澄清石灰水;(3)①过氧化氢氧与二氧化硫反应生成硫酸,反应的化学方程式为H2O2+SO2=H2SO4;②设用10g0.8%的NaOH溶液恰好将吸收液中和至中性时需要硫酸的质量为x。
=3:4,化学式为Fe3O4;(2)钢样灼烧生成的气体是 SO2和CO2,检验前者需要的试剂是高锰酸钾溶液,检验后者需要的试剂是澄清石灰水;(3)①过氧化氢氧与二氧化硫反应生成硫酸,反应的化学方程式为H2O2+SO2=H2SO4;②设用10g0.8%的NaOH溶液恰好将吸收液中和至中性时需要硫酸的质量为x。
2NaOH+H2SO4=Na2SO4+2H2O
80 98
10g×0.8% x
![]()
x=0.098g
硫元素的质量为0.098g×![]() =0.032g;二氧化硫的质量为0.032g÷
=0.032g;二氧化硫的质量为0.032g÷![]() =0.064g;二氧化碳的质量为0.614g-0.064g=0.55g;碳元素的质量为0.55g×
=0.064g;二氧化碳的质量为0.614g-0.064g=0.55g;碳元素的质量为0.55g×![]() =0.15g;该钢样中硫元素的质量分数为
=0.15g;该钢样中硫元素的质量分数为![]() =0.32%;该钢样中碳元素的质量分数为
=0.32%;该钢样中碳元素的质量分数为![]() =0.15%。
=0.15%。

【题目】火锅是我国独创的美食,历史悠久。火锅常用的一种燃料是固体酒精。某化学兴趣小组的同学对“固体酒精”产生了好奇,对其成分进行探究。请你回答下列问题。
查阅资料
a.固体酒精是用酒精、氯化钙和氢氧化钠按一定的质量比混合制成。
b.氯化钙、氯化溶液均呈中性。
(提出问题)
①酒精中是否含有碳元素?
②固体酒精中的氢氧化钠是否变质?
(实验探究)
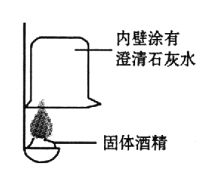
①按右图所示进行实验,发现烧杯内壁有一层白膜,可得出酒精中含有碳元素的结论,理由是_______________。
②取少量固体酒精于烧杯中,加足量的水充分溶解后静置,发现烧杯底部有白色沉淀,请用化学方程式表示该沉淀是如何形成的:_______________由此说明氢氧化钠已变质。
③为进一步确定氢氧化钠的变质程度,分组进行探究。
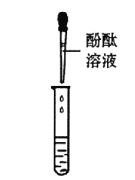
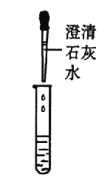
甲组同学取烧杯上层清液于两支试管中,按下图所示进行实验。
实验方案 |
|
|
实验现象 | 溶液变红 | 产生______________ |
实验结论 | 清液中有氢氧化钠 | 清液中有碳酸钠 |
乙组同学认为甲组实验不能证明清液中一定有氢氧化钠,理由是_______________
他们另取烧杯中上层清液,加足量氯化钡溶液,充分反应后,静置,取上层清液,滴加酚酞溶液,酚酞溶液变红。
(反思交流)乙组实验中加足量氯化钡溶液的目的是_____________
(实验结论]小组同学经过讨论,一致认为该固体酒精中的氢氧化钠部分变质。