题目内容
【题目】在一烧杯中盛有2.4g金属镁,向其中加入一定质量的稀硫酸,充分反应后,向所得溶液中逐滴滴入未知溶质质量分数的氢氧化钠溶液,产生沉淀与滴入氢氧化钠溶液的质量关系曲线如图所示。
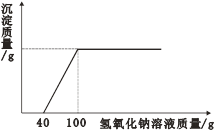
(1)完全反应后,产生沉淀的质量为________g;
(2)氢氧化钠溶液中溶质的质量分数是_________?(写出计算过程,结果精确到0.1%)
【答案】 5.8 13.3%
【解析】(1)完全反应后,产生沉淀的质量为∶Mg→Mg﹙OH﹚2,24→58,![]() =
=![]() ,x=5.8g。
,x=5.8g。
(2)解∶设氢氧化钠溶液中溶质的质量分数是x
2NaOH+MgSO4=Mg﹙OH﹚2↓+Na2SO4
80 58
60g×x 5.8g
![]() =
=![]() ,x=13.3%。
,x=13.3%。
点睛∶(1)完全反应后,产生沉淀的质量为5.8g。(2)氢氧化钠溶液中溶质的质量分数是13.3%。
点睛∶硫酸先与金属镁反应生成硫酸镁和氢气,然后硫酸镁再与氢氧化钠反应生成氢氧化镁白色沉淀和硫酸钠。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案【题目】学习了《海水“制碱”》一课后,同学们模拟“侯氏制碱法”进行实验.
(查阅资料)氨气(NH3)是一种有刺激性气味的气体,极易溶于水,其水溶液显碱性.
(模拟实验)验证侯氏制碱法能获得纯碱
步骤 | 实验装置 | 实验操作及现象 | 解释与结论 |
(1) |
| 先从a管通入____(填 “CO2”或“NH3”),一段时间后,再从b管通入___(填“CO2”或“NH3”),溶液中有固体析出 | 蘸有稀硫酸的棉花可吸收过量的氨气,以免挥发到空气中。 |
(2) |
| 充分加热,观察到的现象是:试管口有水珠,烧杯中的导管口有气泡冒出,____。 | 步骤1析出的固体是碳酸氢钠 |
(3) |
| 滴加足量稀盐酸,有气泡产生,固体逐渐消失 | 步骤2加热后得到的固体是纯碱 |
步骤1发生反应的化学方程式为 ______________。
(实验反思)(1)同学们认为步骤3的实验还不足以得出“步骤2加热后得到的固体是纯碱”的结论,经过讨论,大家一致认为需要补充的实验是____________。
(2)也有同学认为制得的纯碱中可能含有氯化钠杂质, 于是又设计了以下实验并得出结论:
实验操作 | 实验现象 | 实验结论 |
_________ | ____________ | 制得的纯碱中含有氯化钠 |