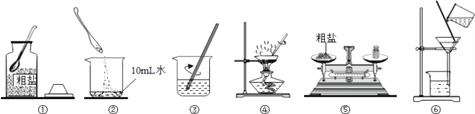
题目内容
【题目】材料是人类赖以生存和发展的重要物质,铜是目前使用最广泛的金属之一。
(一)铜材料的有关知识
(1)人类使用金属先后经历了“青铜”、“铁器”时代,直到近代才开始大量使用铝材料。这也反映出Cu、Fe、Al三种金属的活动性由强到弱的顺序是________。
(2)纯铜又称紫铜,常见铜合金有黄铜、青铜等种类。家用电缆常用紫铜,以聚氯乙烯塑料或TPU橡胶包裹。
① 以上叙述中不涉及到的材料是_______(选填序号)。
A.金属材料 B.无机非金属材料 C.有机合成材料
② 我国在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理_______。
③ 鉴别黄铜和黄金,以下方法不可行的是______(选填序号)。
A.观察颜色 B.加稀盐酸 C.在空气中灼烧
(二)铜及其化合物的实验
I.硫酸铜是制备其他含铜化合物的重要原料,以下是制取硫酸铜的常见方法。
(1)方案1:向稀硫酸中加入铜粉,再用导管通入空气并加热,铜粉逐渐减少,溶液由无色变为蓝色。
①反应中溶液的PH逐渐_________(填“增大”或“减小”)。
②该反应的化学方程式_________。
(2)方案2:将铜片加入浓硫酸中,加热,产生刺激性气味,溶液逐渐变成蓝色。将产生的气体通入酸性高锰酸钾溶液中,溶液褪色,说明该气体是________。
(3)从环保角度进行比较,你认为方案_______(填“1”或“2”)更合理。
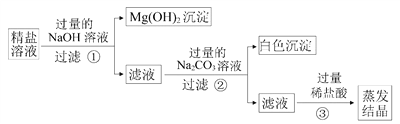
Ⅱ.在一定量硫酸铜溶液中加入碳酸钠溶液,过滤、洗涤、低温干燥得到碱式碳酸铜固体,其组成为:xCuCO3·yCu(OH)2·zH2O。能证明固体已洗净的方法为__________。
(三)碱式碳酸铜的热分解实验
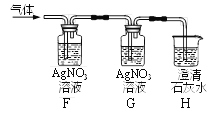
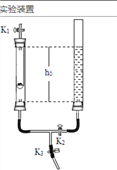
兴趣小组称取此固体12.0g,在科研人员的指导下用下图装置进行热分解实验。

【查阅资料】Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃~220℃,各生成对应的两种氧化物。该碱式碳酸铜失去结晶水的温度与Cu(OH)2的分解温度接近。
(1)装置A的作用是___________。
(2)加热前后及过程中均通入空气,加热后通空气的目的是________。
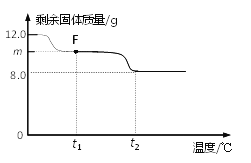
(3)控制温度在不同的范围对B中样品加热。测得装置C、D的质量在实验前后的变化情况如下表所示,测得B中剩余固体质量随温度的变化如下图所示。
装置 | 实验前/g | 实验后/g |
C | 198.0 | 199.8 |
D | 221.0 | 223.2 |
①图中F点对应的m=__________。
② 根据提供的数据, xCuCO3·yCu(OH)2·zH2O中x ﹕y ﹕z = _________。
③ 若缺少装置E,测得的________(选填“x”、“y”、“z”)的值会偏大。
【答案】 Al、Fe、Cu 或Al>Fe>Cu B Fe + CuSO4 =FeSO4+Cu A 增大 2Cu + O2 +2H2SO4![]() 2CuSO4+2H2O SO2 1 取最后一次洗涤后的滤液,滴入BaCl2,无现象(合理的答案均给分) 除去通入空气中的CO2和H2O 使生成的气体被相应装置完全吸收或防止倒吸(合理的答案均给分) 10.2 1 ﹕1 ﹕1 x z
2CuSO4+2H2O SO2 1 取最后一次洗涤后的滤液,滴入BaCl2,无现象(合理的答案均给分) 除去通入空气中的CO2和H2O 使生成的气体被相应装置完全吸收或防止倒吸(合理的答案均给分) 10.2 1 ﹕1 ﹕1 x z
【解析】本题考查了实验探究物质的组成成分以及含量,金属、盐的性质,材料的分类,化学方程式的计算等,综合性较强,难度较大。
(一)铜材料的有关知识
(1)根据金属活动顺序表可知 Cu、Fe、Al三种金属的活动性由强到弱的顺序是Al、Fe、Cu 或Al>Fe>Cu;
(2) ①纯铜、黄铜、青铜均属于金属材料,聚氯乙烯塑料和TPU橡胶均属于有机合成材料,以上叙述不涉及到的材料是无机非金属材料,故选B;
②“曾青得铁则化为铜”可以是铁与硫酸铜反应生成硫酸亚铁和铜,化学方程式是Fe + CuSO4 =FeSO4+Cu;
③ A、黄铜和黄金都是黄色,颜色相同,不能通过观察颜色区分,错误; B、黄铜是铜与锌的合金加入稀盐酸后有气泡产生,黄金活动性较弱不能与盐酸反应,加入稀盐酸后无明显变化,现象不同可以区分,正确;C.黄铜在空气中灼烧固体变黑,黄金在空气中灼烧无明显变化,现象不同可以区分,正确。故选A;
(二)铜及其化合物的实验
(1)①溶液中的硫酸不断被消耗,酸性减弱,反应中溶液的pH逐渐增大;
②该反应是铜和氧气和硫酸反应生成硫酸铜和水,化学方程式是2Cu + O2 +2H2SO4![]() 2CuSO4+2H2O;
2CuSO4+2H2O;
(2)二氧化硫能使高锰酸钾溶液褪色,将产生的气体通入酸性高锰酸钾溶液中,溶液褪色,说明该气体是SO2;
(3)实验2产生的二氧化硫排放到空气中会形成酸雨。从环保角度进行比较,你认为方案1更合理。
Ⅱ.若固体洗净,洗涤液中不含有碳酸钠,氯化钡溶液能与碳酸钠溶液生成碳酸钡的沉淀。能证明固体已洗净的方法为取最后一次洗涤后的滤液,滴入BaCl2,无现象(合理的答案均给分);
(三)碱式碳酸铜的热分解实验
(1)该实验是通过测定碱式碳酸铜分解产生的二氧化碳和水的质量来测定碱式碳酸铜的组成,空气中的二氧化碳和水对实验有干扰,装置A的作用是除去通入空气中的CO2和H2O;
(2)加热后装置中有反应生成的二氧化碳和水,加热后通空气的目的是使生成的气体被相应装置完全吸收或防止倒吸(合理的答案均给分);
(3) ①Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃~220℃,各生成对应的两种氧化物。该碱式碳酸铜晶体失去结晶水的温度与Cu(OH)2的分解温度接近,根据图示可知F点是碱式碳酸铜晶体失去了结晶水、Cu(OH)2已分解。装置C是吸收反应产生的水,水的质量=199.8g-198.0g=1.8g 所以m=12g-1.8g=10.2g;
②装置D是吸收反应产生的二氧化碳,二氧化碳的质量=223.2g-221.0g=2.2g,设:生成2.2g的二氧化碳,需要碳酸铜的质量为a,生成的氧化铜的质量为b。
CuCO3![]() CuO+CO2↑
CuO+CO2↑
124 80 44
a b 2.2g
![]() x=6.2g
x=6.2g
![]() y=4g
y=4g
碱式碳酸铜晶体完全分解后的固体产物中氧化铜。氢氧化铜分解产生的氧化铜=8g-4g=4g,设:分解产生4g的氧化铜需要氢氧化铜的质量为c,同时生成水的质量为d。
Cu(OH)2![]() CuO+H2O
CuO+H2O
98 80 18
C 4g d
![]() c=4.9g
c=4.9g
![]() d=0.9g
d=0.9g
碱式碳酸铜晶体中结晶水的质量=1.8g-0.9g=0.9g。在碱式碳酸铜晶体中:
124x:98y:18z=6.2g:4.9g:0.8g,x ﹕y ﹕z =1 ﹕1 ﹕1;
③装置E是防止空气中的水和二氧化碳进入D装置,若缺少装置E,

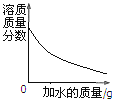
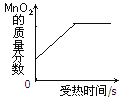
【题目】下列四个坐标图分别表示四个实验过程中某些量的变化,其中不正确的是( )
|
|
|
|
过氧化氢 溶液分解 | B.向盐酸和氯化钙的混合溶液中滴加 碳酸钠溶液 | C.在一定温度下,向有氯化钠固体的氯化钠溶液中加入水搅拌 | D.给氯酸钾和二氧化锰的混合物加热 |
A. A B. B C. C D. D