题目内容
【题目】某同学按照课本做“粗盐中难溶性杂质的去除”实验,并用所得的精盐配制200g质量分数为20%的氯化钠溶液。
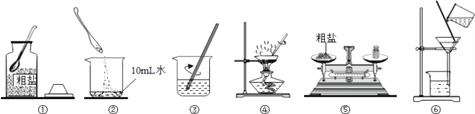
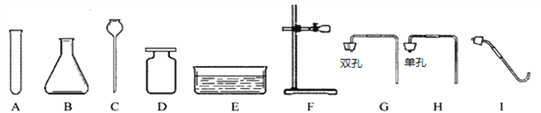
实验一:如图是同学们做“粗盐中难溶性杂质的去除”实验的操作示意图。
(1)操作③中玻璃棒的作用是________;
(2)某同学所得精盐比其他同学明显要少,原因可能是________(填序号)。
A.粗盐倒入水中立即过滤 B.蒸发时有固体溅出 C.提纯后所得精盐尚未完全干燥
实验二:用正确方法提纯得到的精盐配制200g质量分数为40%的氯化钠溶液。
在量取水时仰视读数,其他操作都正确,则他的错误操作会导致配制的溶液质量分数____(选填“偏大”、“偏小”或“不变”)。
某同学想将配制的200g40%的氯化钠溶液稀释成20%的氯化钠溶液需加水________g
(3)提纯后得到的“精盐”中除了NaCl还含有少量的可溶性杂质CaCl2 、MgCl2 ,小青同学设计了以下实验方案来除去可溶性杂质
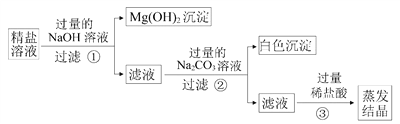
步骤①反应的化学方程式_________________
步骤②中得到的白色沉淀是____________(填化学式)
步骤③中加稀盐酸是为了除去溶液中的__________________(填序号)
①CaCl2 ② MgCl2 ③ NaOH ④Na2CO3
(4)蒸发结晶前加入“过量的稀盐酸”不能使氯化钠不纯,原因是_____________
【答案】 搅拌加快溶解速率 AB 偏小 200 MgCl2+2NaOH=Mg(OH)2 +2NaCl CaCO3 ④ 浓盐酸有挥发性
【解析】实验一(1)操作③中用玻璃棒搅拌的作用是加速粗盐的溶解;(2) 粗盐倒入水中立即过滤,有没溶解的氯化钠被过滤掉了,所以所得精盐少了;蒸发时有一些液体、固体溅出,会导致氯化钠减少,所得精盐比其他同学明显要少;提纯后所得精盐尚未完全干燥,只能导致质量增多,故选:AB;实验二:量取水时,仰视读数会使量取的水偏多,从而导致溶质质量分数偏小;某同学想将配制的200g40%的氯化钠溶液稀释成20%的氯化钠溶液需加水x g,则根据稀释前后溶质的质量不变:200g×40%=(200+ x)×20%,解得x=200g;(3)①步骤①是氢氧化钠和氯化镁反应生成氢氧化镁白色沉淀和氯化钠,反应的化学方程式为:MgCl2+2NaOH=Mg(OH)2 +2NaCl;②步骤②是碳酸钠和氯化钙反应生成碳酸钙白色沉淀和氯化钠,故白色沉淀是CaCO3;步骤③中加稀盐酸是为了除去溶液中的碳酸钠,化学方程式为:Na2CO3+2HC![]() 2NaCl+2H2O+ CO2↑;(4)蒸发结晶前加入“过量的稀盐酸”不能使氯化钠不纯,原因是浓盐酸有挥发性。
2NaCl+2H2O+ CO2↑;(4)蒸发结晶前加入“过量的稀盐酸”不能使氯化钠不纯,原因是浓盐酸有挥发性。

【题目】材料是人类赖以生存和发展的重要物质,铜是目前使用最广泛的金属之一。
(一)铜材料的有关知识
(1)人类使用金属先后经历了“青铜”、“铁器”时代,直到近代才开始大量使用铝材料。这也反映出Cu、Fe、Al三种金属的活动性由强到弱的顺序是________。
(2)纯铜又称紫铜,常见铜合金有黄铜、青铜等种类。家用电缆常用紫铜,以聚氯乙烯塑料或TPU橡胶包裹。
① 以上叙述中不涉及到的材料是_______(选填序号)。
A.金属材料 B.无机非金属材料 C.有机合成材料
② 我国在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理_______。
③ 鉴别黄铜和黄金,以下方法不可行的是______(选填序号)。
A.观察颜色 B.加稀盐酸 C.在空气中灼烧
(二)铜及其化合物的实验
I.硫酸铜是制备其他含铜化合物的重要原料,以下是制取硫酸铜的常见方法。
(1)方案1:向稀硫酸中加入铜粉,再用导管通入空气并加热,铜粉逐渐减少,溶液由无色变为蓝色。
①反应中溶液的PH逐渐_________(填“增大”或“减小”)。
②该反应的化学方程式_________。
(2)方案2:将铜片加入浓硫酸中,加热,产生刺激性气味,溶液逐渐变成蓝色。将产生的气体通入酸性高锰酸钾溶液中,溶液褪色,说明该气体是________。
(3)从环保角度进行比较,你认为方案_______(填“1”或“2”)更合理。
Ⅱ.在一定量硫酸铜溶液中加入碳酸钠溶液,过滤、洗涤、低温干燥得到碱式碳酸铜固体,其组成为:xCuCO3·yCu(OH)2·zH2O。能证明固体已洗净的方法为__________。
(三)碱式碳酸铜的热分解实验
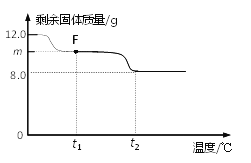
兴趣小组称取此固体12.0g,在科研人员的指导下用下图装置进行热分解实验。

【查阅资料】Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃~220℃,各生成对应的两种氧化物。该碱式碳酸铜失去结晶水的温度与Cu(OH)2的分解温度接近。
(1)装置A的作用是___________。
(2)加热前后及过程中均通入空气,加热后通空气的目的是________。
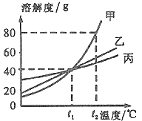
(3)控制温度在不同的范围对B中样品加热。测得装置C、D的质量在实验前后的变化情况如下表所示,测得B中剩余固体质量随温度的变化如下图所示。
装置 | 实验前/g | 实验后/g |
C | 198.0 | 199.8 |
D | 221.0 | 223.2 |
①图中F点对应的m=__________。
② 根据提供的数据, xCuCO3·yCu(OH)2·zH2O中x ﹕y ﹕z = _________。
③ 若缺少装置E,测得的________(选填“x”、“y”、“z”)的值会偏大。