题目内容
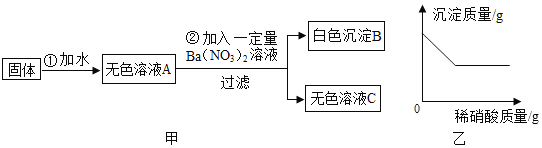
【题目】实验室有一瓶存放很久的生石灰,小轩同学想了解其变质情况,设计如下实验:
(实验1):取少量样品于烧杯中,加入一定量水,触摸烧杯外壁,感觉发热。充分 搅拌后过滤,得到白色沉淀和无色滤液。小轩同学对样品的组成提出了以下假设:
假设1.是Ca(OH)2和CaCO3的混合物,
假设2.是CaO和CaCO3的混合物,
假设3.是CaO和Ca(OH)2的混合物,
假设4.是CaO、Ca(OH)2、CaCO3的混合物。
(1)通过实验现象可以直接看出,其中假设____________不合理。
(2)为了判断其他几种假设的合理性,他继续进行实验:
(实验2):取少量沉淀放在试管中,加入足量稀盐酸,产生气泡,由此可否定假设____________。
(实验3):取少量滤液放在另一支试管中,加入碳酸钠溶液后溶液变浑浊,反应的化学方程式为:____________,于是小轩同学得到结论:只有假设4合理。但你认为此实验仍不能得到最后结论,请说明原因:____________。
(3)为了得到最后结论,小轩在老师的指导下设计了如下实验:
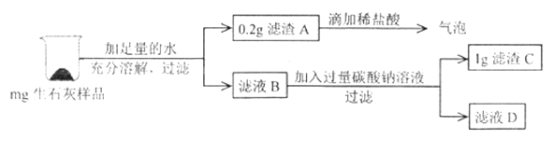
向滤液D中逐滴加入过量稀盐酸,观察到的现象是________________________;
通过上述实验,小轩最终得出假设4成立,请根据所给实验数据进行计算,推测他所称取的生石灰样品的质量范围是________________________。
【答案】1 3 Ca(OH)2+Na2CO3=CaCO3+2NaOH 氧化钙与水反应生成氢氧化钙 一段时间后产生气泡 0.76g<m<0.94g
【解析】
[实验1]
(1)根据实验1,触摸烧杯外壁,感觉发热,说明样品中含有氧化钙,因此假设1不合理,故填1;
(2)
[实验2]
取少量沉淀放在试管中,加入足量稀盐酸,产生气泡,说明固体中含有碳酸钙,由此可否定假设3,故填3;
[实验3]
取少量滤液放在另一支试管中,加入碳酸钠溶液后溶液变浑浊,说明滤液中含有氢氧化钙,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,方程式故填Ca(OH)2+Na2CO3=CaCO3+2NaOH;氧化钙能和水反应生成氢氧化钙,不能确定样品中是否含有氢氧化钙,此实验仍不能得到最后结论,故填氧化钙与水反应生成氢氧化钙;
(3)由实验流程可知滤液D中含有反应生成的氢氧化钠和过量的碳酸钠,氢氧化钠先和稀盐酸反应生成氯化钠和水,氢氧化钠反应完碳酸钠再和稀盐酸反应生成二氧化碳,一段时间后观察到有气泡产生,故填一段时间后产生气泡;
最终得出假设4成立,即样品是CaO、Ca(OH)2、CaCO3的混合物,反应生成1g滤渣C,说明碳酸钠和氢氧化钙反应生成了1g碳酸钙,设和碳酸钠反应的氢氧化钙质量为x,

74∶100=x∶1g
解得x=0.74g,
设和水反应生成0.74g氢氧化钙的氧化钙质量为y,
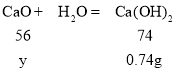
56∶74=y∶0.74g
解得y=0.56g,
又因为滤渣A的质量为0.2g,则称取的生石灰样品的质量范围是0.56g+0.2g<m<0.74g+0.2g,即0.76g<m<0.94g,故填0.76g<m<0.94g。

 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案【题目】下列实验方法能达到实验目的的是
选项 | 实验目的 | 实验方法 |
A | 鉴别 | 分别点燃,并在火焰上方罩干冷烧杯 |
B | 除去 | 将混合气通入足量澄清石灰水 |
C | 检验 | 加入适量饱和氯化钙溶液 |
D | 将不饱和的氯化钠溶液变饱和溶液 | 加入少量氯化钠固体 |
A.AB.BC.CD.D