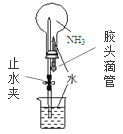
题目内容
【题目】有一包固体物质,可能含有硫酸钠、碳酸钠、氯化钙、氯化钾、氯化铁和氢氧化钠中的一种或几种。为探究其组成,进行如图实验:
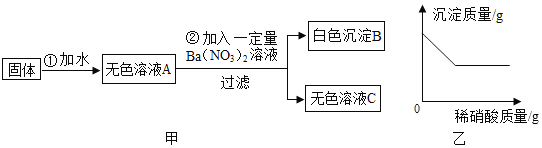
(1)取少量固体按图甲实验,根据步骤①可知固体中一定不含有_____。
(2)取白色沉淀B于烧杯中并逐滴加入稀硝酸,烧杯中的沉淀质量随滴加稀硝酸质量的变化如图乙所示。则可确定原固体中一定含有_____
(3)取无色溶液C向其中通入二氧化碳气体,产生白色沉淀,无色溶液C中一定含有的离子是_____(填离子符号)
(4)为进一步确定原固体中可能含有的物质是否存在,应采用的操作步骤是_____,通过观察现象即可确定。
【答案】氯化铁(或FeCl3) 碳酸钠和硫酸钠(或Na2CO3和Na2SO4) Na+、NO3-、Ba2+、OH- 取无色溶液C少许于试管中,加入足量的稀硝酸,然后再加入硝酸银溶液(合理即可)
【解析】
加水溶解为无色溶液A,氯化铁溶液呈黄色,故固体中不含有氯化铁,碳酸钠和氯化钙反应会产生碳酸钙沉淀,因此二者不能共存,碳酸钠和氯化钙至少有一种不存在;加入一定量硝酸钡产生白色沉淀B,硝酸钡溶液与碳酸钠溶液反应生成硝酸钠和碳酸钡沉淀,硝酸钡溶液与硫酸钠溶液反应生成硝酸钠和硫酸钡沉淀,所以碳酸钠和硫酸钠至少存在一种。
根据以上分析可知:
(1)取少量固体按图甲实验,根据步骤①可知固体中一定不含有氯化铁;
(2)取白色沉淀B于烧杯中并逐滴加入稀硝酸,烧杯中的沉淀质量随着滴加稀硝酸质量的变化如图乙所示。根据图示可知,沉淀部分溶解,碳酸钡能与稀硝酸反应生成硝酸钡、水和二氧化碳,硫酸钡不溶于稀硝酸,白色沉淀B是碳酸钡与硫酸钡的混合物,则可确定原固体中一定含有碳酸钠和硫酸钠,一定不存在氯化钙;
(3)无色溶液C中一定存在硝酸钠,可能存在氢氧化钠、氯化钾、硝酸钡(过量的),或可能存在氢氧化钠、氯化钾、碳酸钠(过量的),或可能存在氢氧化钠、氯化钾、硫酸钠(过量的)。取无色溶液C向其中通入二氧化碳气体,产生白色沉淀,一定是二氧化碳与溶液中的氢氧化钠反应生成碳酸钠,碳酸钠与硝酸钡反应生成硝酸钠和碳酸钡白色沉淀,所以溶液C中一定存在硝酸钠、氢氧化钠和硝酸钡,无色溶液C中一定含有的离子是Na+、NO3-、Ba2+、OH-;
(4)根据上述分析可知,原固体中可能含有的物质是氯化钾,氯化钾与硝酸银反应生成氯化银和硝酸钾,确定原固体中可能含有的物质是否存在,应采用的操作步骤是取无色溶液C少许于试管中,加入足量的稀硝酸,然后再加入硝酸银溶液,若有白色沉淀则存在氯化钾。

【题目】化学源于生活,服务于生活。研究“水”可从多角度展开。
(1)水的电解
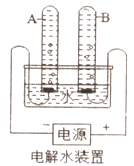
①宏观现象:按如图所示装置,通电一段时间后,试管A、B中产生气体的体积比约为_____,常在水中加入氢氧化钠的作用是_____。
②微观该反应中发生分解的微粒名称是_____,没有发生变化的粒子符号是_____。
(2)水的性质
将黄豆大小的金属钾放入盛有水的烧杯中,生成氢气和氢氧化钾。写出该反应的化学方程式_____。
(3)下列与水有关的实验中,实验和对应的解析都正确的是_____。
实验操作 | 解析 | |
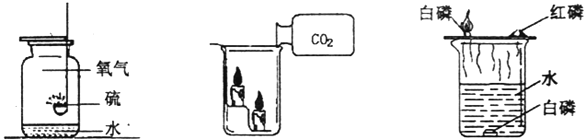
A | 将燃烧的硫放盛有入留有少量水的氧气的集气瓶中 | 水可以吸收生成的二氧化硫,防止有毒气体外逸污染空气 |
B | 粗盐的提纯用到水溶解粗盐再过滤 | 根据物质在水中的溶解性的不同,把混合物进行分离除杂 |
C | 用水灭火 | 水能吸收热量,从而降低环境温度到可燃物着火点以下 |
D | 用氯化钠溶液进行导电性试验,观察小灯泡是否变亮 | 小灯泡变亮,说明氯化钠溶液中存在自由移动的离子 |