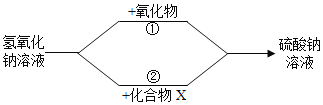
题目内容
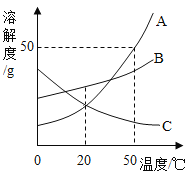
【题目】如图是a、b、c三种物质的溶解度曲线,据图回答下列问题。
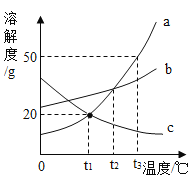
(1)三种物质的溶解度随温度升高而减小的是____________。
(2)t2℃时,物质a的溶解度与物质_________的溶解度相等。
(3)t3℃时,把80g物质a加入到200g水中充分搅拌、静置,形成的是_________溶液(填“饱和”或“不饱和”),此时溶液中溶质的质量分数为___________。
(4)将t3℃时等质量a和b的饱和溶液降温到t1℃,析出晶体的质量关系正确的是________。
Aa>b Ba=b Ca<b D无法确定
【答案】c b 不饱和 28.6% A
【解析】
(1)由溶解度曲线可知,三种物质的溶解度随温度升高而减小的是c。故填:c;
(2)溶解度曲线的交点表示物质的溶解度相等,t2℃时,物质a的溶解度与物质b的溶解度相等,故填:b;
(3)t3℃时,把80g物质a加入到200g水中充分搅拌、静置,形成的是不饱和溶液,因为在该温度下,a的溶解度是50g,200g水最多能溶解100ga物质;此时溶液中溶质的质量分数为![]() 。故填:不饱和;28.6%;
。故填:不饱和;28.6%;
(4)t3℃时,将等质量物质a和物质b的饱和溶液降到t1℃时,析出晶体的质量关系正确的是:a>b,因为a的溶解度受温度的影响变化比较大;故填:A。

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目