题目内容
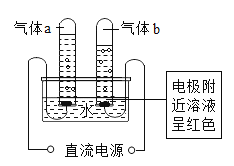
【题目】结合验证铁、铜、银活动性的实验,回答下列问题:
(1)将铜丝和铁丝分别放入相同的浓度的稀H2SO4中,依据____________现象,可以判断 Fe 的活动性比Cu 强;
(2)将铜丝放入AgNO3 溶液中,Cu 与AgNO3 溶液反应的化学方程式为__________;
(3)铝比铁活泼,但铝比铁的耐腐蚀性强,原因是__________。
(4)向 AgNO3 和 Cu(NO3)2 的混合溶液中加入一定量的 Zn 粉,充分反应后过滤,向滤渣中加盐酸有气泡,则滤渣中一定含有的金属是__________。
【答案】铁丝表面有气泡,而铜丝表面没有 Cu+2AgNO3=Cu(NO3)2+2Ag 铝的表面有一层致密的氧化铝薄膜 Ag Cu Zn
【解析】
(1)铁是活泼金属,可与酸反应生成氢气,铜的活泼性较弱,不与酸反应,故填“铁丝表面有气泡,而铜丝表面没有”;
(2)Cu的活泼性比银强,可以把银从其盐溶液中置换出来,故Cu与AgNO3 溶液反应的化学方程式为![]() ;
;
(3)铝的表面有一层致密的氧化铝薄膜,故虽然铝比铁活泼,但铝比铁的耐腐蚀性强,故填“铝的表面有一层致密的氧化铝薄膜”;
(4)向 AgNO3 和 Cu(NO3)2 的混合溶液中加入一定量的 Zn 粉,Zn先置换Ag,将Ag置换完全后才置换Cu;充分反应后过滤,向滤渣中加盐酸有气泡说明Zn过量,即Zn将Ag、Cu置换完全后还有剩余,故滤渣的成分有Ag、Cu、Zn,故填“Ag Cu Zn”。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案【题目】分析数据,获得信息实验室现有硫酸铜和硫酸钠的固体混合物样品,小明同学想测定样品中硫酸铜的质量分数。先称取该混合物样品 25g,完全溶于水中,然后取用了一定溶质质量分数的氢氧化钠溶液 100g 平均分四次加入其中,充分振荡,相关实验数据记录如下:
第1次 | 第2次 | 第3次 | 第4次 | |
加入氢氧化钠溶液的质量/g | 25 | 25 | 25 | 25 |
生成沉淀的质量/g | 4.9 | 9.8 | X | 14.7 |
请回答下列问题:
(1)上表中 X 的数值为_____________;
(2)计算原固体混合物样品中硫酸铜的质量分数为_____________? (写出计算步骤)
【题目】KCl和KNO3在不同温度下的溶解度数据如表所示,下列说法中正确的是
温度/℃ | 20 | 30 | 60 | |
溶解度/g | KCl | 33 | 38 | 45 |
KNO3 | 31 | 64 | 110 |
A. 60℃时,100g水中最多溶解45 g KCl
B. 随着温度的升高,某饱和KCl溶液中会有固体析出
C. KNO3的溶解度始终大于KCl
D. 60℃时,某KNO3溶液中溶质的质量分数一定为 ![]()