题目内容
【题目】铝及其化合物有极其重要的用途。
(一)铝的广泛应用
(1)铝是很活泼的金属,但用铝制做的炊具却耐腐蚀,其原因是____________(用方程式表示)。
(2)使用铝制炊具会使人体摄入过量的“铝”,导致记忆力减退等不良症状。这里的“铝”是指______________。
A单质 B元素 C原子 D分子
(二)硫酸铝铵晶体(NH4Al(SO4)2·xH2O)是一种用途广泛的含铝化合物。兴趣小组在科研人员指导下,设计实验探究硫酸铝铵晶体受热分解的产物。
(查阅资料)①SO2可与稀KMnO4溶液反应使其褪色。
②SO3+H2O=H2SO4。
③硫酸铝铵热分解完全可得到纳米氧化铝。
④碱石灰是CaO和NaOH的混合物。
(1)硫酸铝铵(NH4Al(SO4)2)中铝元素的化合价为____________。
(2)硫酸铝铵晶体分解产物的定性探究
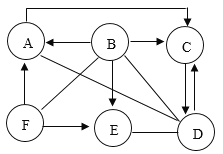
①装置C中观察到酚酞溶液变红色,由此可知分解的产物中有__________(写化学式)。
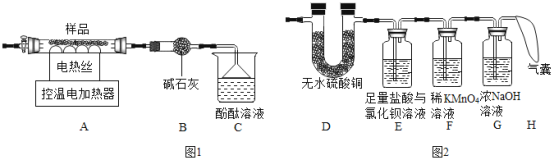
②某同学认为硫酸铝铵晶体受热分解的产物中还有H2O、SO2、SO3和N2。为进行验证,用图1中的装置A和图2所示装置连接进行实验。实验中,装置D中现象是___________________ ,证明有H2O生成;装置E中现象是______________,证明有SO3生成;而装置F中现象是____________、H最终没有胀大,证明没有SO2和N2生成。
(三)硫酸铝铵晶体成分及分解产物的定量探究:为确定硫酸铝铵晶体的组成,称取45.3g样品在空气中持续加热,测定剩余固体质量随温度变化的曲线如下图所示。
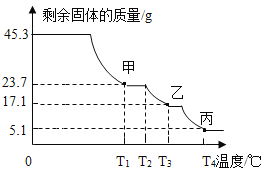
(1)固体甲是T1℃刚好完全失去结晶水的产物,则x =_________。(写出计算过程)
(2)T3℃时固体乙的成分是_______________(填字母)。
AAl2(SO4)3 BAl(OH)3 CAl2(SO4)3和Al(OH)3
【答案】4Al+3O2═2Al2O3 B +3 NH3 固体变为蓝色 有白色沉淀生成 无明显现象 12 A
【解析】
(一)(1)铝是很活泼的金属,但用铝制作的炊具却耐腐蚀,其原因是铝易与空气中的氧气反应在其表面形成了致密的氧化铝的薄膜,反应的化学方程式是:4Al+3O2═2Al2O3;故填:4Al+3O2═2Al2O3;
(2)物质的组成常用元素来描述,长期使用铝制炊具会使人体摄入过量的“铝”,不利人体健康,这里的“铝”是指元素;故填:B;
(二)(1)硫酸铝铵[NH4Al(SO4)2]中铵根显+1价,硫酸根显-2价,设铝元素的化合价为x,根据化合物中元素化合价代数和为0,则(+1)+x+(-2)×2=0,x=+3。故填:+3;
(2)①装置C中观察到酚酞溶液变红色,说明硫酸亚铁铵晶体受热时会分解生成碱性气体,根据质量守恒定律该气体应该是NH3,故填:NH3;
②无水硫酸铜遇水变蓝,装置D中现象是无水硫酸铜遇水变蓝,证明有H2O生成;三氧化硫能与水反应生成硫酸,硫酸与氯化钡溶液反应生成硫酸钡白色沉淀和盐酸,若有三氧化硫生成,则装置E中会有白色沉淀生成;二氧化硫具有漂白性,可使紫色高锰酸钾溶液褪色,若没有SO2和N2生成,则F装置中的高锰酸钾溶液不褪色,装置H最终也不胀大。
故填:固体变为蓝色;有白色沉淀生成;无明显现象;
(三)(1)固体甲是T1℃刚好完全失去结晶水的产物,
则:(237+18x):18x=45.3g:(45.3g-23.7g)
x=12
故填:12;
(2)T1℃→T3℃时,NH4Al(SO4)2分解生成氨气和硫酸铝,可以推知乙的成分是硫酸铝。
故填:A。

【题目】酸、碱、盐是我们身边重要的化合物,在生活和生产中具有广泛的应用。
(1)某锅炉水垢的主要成分有CaCO3、Mg(OH)2、Fe2O3,用“酸洗”法可除去该水垢。但“酸洗”时,一般不选用稀硫酸的原因是_______________。
(2)春秋末期齐国的工艺官书《考工记》中载有“涑帛”的方法,即利用“灰”(草木灰:K2CO3)和“蜃”(贝壳灰:CaO)混合加水所得溶液来洗涤帛,这种溶液能洗涤丝帛是因为其中一定含有的物质是______________(水除外)。
(3)两种抗胃酸药剂的主要成分及建议每次剂量见下表:
主要成分 | NaHCO3 | Mg(OH)2 |
建议每次剂量/g | 0.5 | 0.3 |
①服用Mg(OH)2的药效比服用NaHCO3“强”的原因是_______________。
②写出NaHCO3与胃酸主要成分反应的化学方程式:________________。