题目内容
【题目】分类和类比是学习化学常用的方法。
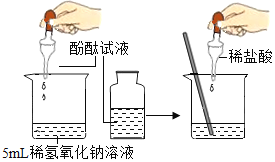
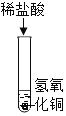
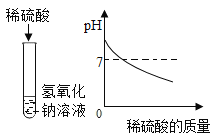
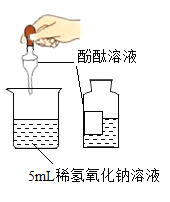
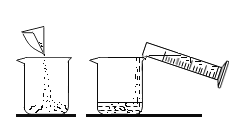
(1)下列实验都能探究酸与碱之间能否发生反应。请从“定性研究”或“定量研究”的角度,将下列实验中的A与_____________ (填字母) 归为一类,理由是________________。
|
|
|
A | B在少量的氢氧化铜固体中加入足量的稀盐酸 | C向氢氧化钠溶液不断滴加稀硫酸,边加边用酸度计测定溶液的pH |
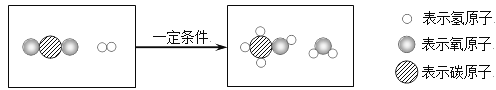
(2)我们学习过铁和稀硫酸的反应:![]() ,高中以后还将学习铁和浓硫酸在加热条件下的反应:
,高中以后还将学习铁和浓硫酸在加热条件下的反应:![]() 。由此可知,反应物相同时,_________和____________不同,生成物不同。
。由此可知,反应物相同时,_________和____________不同,生成物不同。
【答案】B A和B是利用溶液颜色是否改变,固体是否减少等定性角度来探究物质之间能否发生反应,没有从量的角度来探究反应,属于定性研究;而C实验是利用酸度计测得的溶液pH的变化来确定反应能否发生,属于定量研究。 反应物的浓度 反应条件
【解析】
(1)题中三个实验都能探究酸与碱之间能否发生反应。初中阶段“定性研究”一般是利用物质之间反应时出现明显现象,或虽然没有明显实验现象,但通过其他试剂可以判断反应是否进行的角度研究化学反应,而“定量研究”是从反应过程中某个量的变化角度来研究化学反应。因此从“定性研究”或“定量研究”的角度,三个实验中的A与B归为一类,其理由是:A是利用酚酞溶液颜色的改变来判断盐酸和氢氧化钠能发生中和反应,B是利用氢氧化铜固体是否减少,溶液是否变成蓝色来探究两者之间能否发生反应,没有从量的角度来探究反应,都属于定性研究;而C实验是利用酸度计测得的溶液pH的变化来确定反应能否发生,属于定量研究。
(2)根据已学知识,铁和稀硫酸反应生成硫酸亚铁和氢气,其化学方程式是:![]() ,题中提供了高中以后还将学习的铁和浓硫酸在加热条件下的反应:
,题中提供了高中以后还将学习的铁和浓硫酸在加热条件下的反应:![]() 。从这两个反应中可以看出,因为硫酸的浓度不同以及反应是否加热,导致铁和硫酸反应的生成物不同。由此可以得出结论:反应物相同时,反应物的浓度和反应条件不同,生成物不同。
。从这两个反应中可以看出,因为硫酸的浓度不同以及反应是否加热,导致铁和硫酸反应的生成物不同。由此可以得出结论:反应物相同时,反应物的浓度和反应条件不同,生成物不同。

 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案【题目】某学生在一定温度下,向质量均为 100g 的四份水中分别加入一定质量的 KNO3固体,搅拌至充分溶解(如有不能溶解的 KNO3,则过滤除去),得到溶液,该学生在实验 中记录的数据如下:
实验序号 | 实验 1 | 实验 2 | 实验 3 | 实验 4 |
水的质量(g) | 100 | 100 | 100 | 100 |
加入 KNO3 的质量(g) | 80 | 100 | 120 | 140 |
溶液质量(g) | 180 | 200 | 210 | 210 |
(1)根据上述数据分析,实验______________和_____________得到饱和溶液。
(2)KNO3 饱和溶液的质量分数是_____________。(取整数)
(3)该温度下 KNO3 的溶解度是_____________g ( g/100g 水)o