题目内容
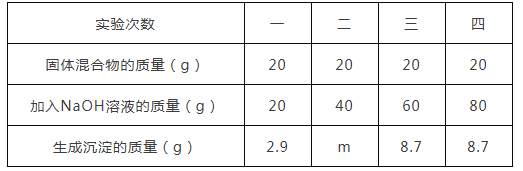
【题目】某同学为了测定NaCl和MgCl2固体混合物中MgCl2的质量分数,进行如下实验:将80g固体混合物溶于水配成溶液,平均分成四份,分别加入相同质量分数的NaOH溶液,获得如表实验数据:
请通过计算回答:
(1)表中m的值为______;
(2)原固体混合物中的MgCl2质量分数是多少_____?(要求写出计算过程)
(3)加入氢氧化钠溶液的溶质质量分数是多少_____?
【答案】5.8 71.25% 20%
【解析】
(1)加入20g氢氧化钠溶液质量得到沉淀2.9g,第三次实验共加入60g氢氧化钠溶液生成沉淀增加了,说明第一次实验中20g氢氧化钠完全反应只能生成2.9g沉淀,假设加入40g氢氧化钠溶液完全反应,则加入40g氢氧化钠溶液质量是20g氢氧化钠溶液质量的2倍,所以40g氢氧化钠完全反应生成的沉淀是2.9g的2倍,即沉淀m值是为:2.9g×2=5.8g,因为5.8g〈8.7g,说明假设成立;
(2)解:设原固体混合物中MgCl2的质量为x,60gNaOH溶液中氢氧化钠的质量为y,根据表中数据,加入60gNaOH氢氧化钠溶液时沉淀质量不再增加,说明已经反应完了,最多生成沉淀8.7g,且8.7g=2.9g×3,说明加入NaOH溶液的质量为60g时恰好完全反应。
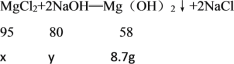
![]()
解得:x=14.25g ,y=12g
则原固体混合物中MgCl2的质量分数为:![]() ×100%=71.25%;
×100%=71.25%;
答:原固体混合物中MgCl2的质量为14.25g,60gNaOH溶液中氢氧化钠的质量为12g,原固体混合物中MgCl2的质量分数为71.25%。
(3)加入的NaOH溶液的质量分数是![]() ×100%=20%;
×100%=20%;
答:加入的NaOH溶液的质量分数是20%。

练习册系列答案
相关题目