1、 溶液的酸碱性与c(H+)和c(OH-)的关系:
投影显示空表,教师引导填写,然后推出结论。
|
电解质 溶液 |
对水电离平衡的影响 |
溶 液 中 c(H+) (mol/L) |
溶 液 中c(OH-)(mol/L) |
c(H+)与 c(OH-)比较 |
c(H+)· c(OH-) |
溶液酸碱性 |
|
纯水 |
|
=10-7 |
=10-7 |
相 等 |
10-14 |
中性 |
|
盐酸 |
加HCl,c(H+)增大,平衡左移 |
>10-7 |
<10-7 |
c(H+)> c(OH-) |
10-14 |
酸性 |
|
氢氧化钠 |
加NaOH,c(OH-)增大,平衡左移 |
<10-7 |
>10-7 |
c(H+)< c(OH-) |
10-14 |
碱性 |
中性溶液c(H+)= c(OH-)= 1×10-7mol/L
酸性溶液c(H+)> c(OH-),c(H+)> 1×10-7mol/L
碱性溶液c(H+)< c(OH-),c(H+)< 1×10-7mol/L
注:①水中加酸或碱均 抑 制水的电离,但由水电离出的c(H+)与c(OH-)总是相等。
②任何电解质溶液中,H+与OH-总是共存,但不能大量共存。溶液的酸、碱性主要在于c(H+)与c(OH-)的相对大小。c(H+)与c(OH-)此增彼长,且Kw = c(H+)·c(OH-)不变。
讲述:酸性溶液中c(H+)越大,酸性越强,碱性溶液中c(OH-)越大,碱性越强。我们经常用到一些c(H+)很小的溶液,如c(H+)=1×10-7 mol/L的溶液,用这样的量来表示溶液的酸碱性的强弱很不方便。为此,化学上常采用pH来表示溶液酸碱性的强弱。
1、水的电离
H2O + H2O 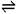 H3O+ + OH- 简写为:H2O
H3O+ + OH- 简写为:H2O 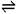 H+ + OH-
H+ + OH-
实验测定:25℃ [H+]=[OH-]=1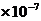 mol/L 100℃ [H+]
= [OH-] = 1
mol/L 100℃ [H+]
= [OH-] = 1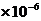 mol/L
mol/L
水的电离与其它弱电解质的电离有何异同?
不同点:水是“自身”作用下发生的极微弱的电离。
相同点:均是部分电离,存在电离平衡
提问:请学生计算水的浓度,1L纯水的物质的量是55·6mol,经实验测得250C时,发生电离的水只有1×10-7mol,二者相比,水的电离部分太小,可以忽略不计。因此电离前后水的物质的量几乎不变,可以视为常数,常数乘以常数必然为一个新的常数,用Kw表示,即为水的离子积常数,简称水的离子积。
板书2、水的离子积
Kw = c(H+)·c(OH-)
由于250C时,c(H+)= c(OH-)= 1×10-7mol/L
所以250C时,Kw = c(H+)·c(OH-)=1×10-14(定值)(省去单位)
提问:当温度升高时,Kw如何变化?影响Kw的因素是什么?(电离过程是吸热过程)
1000C时,Kw = c(H+)·c(OH-)=1×10-12
影响因素:温度越高,Kw越大,水的电离度越大。对于中性水,尽管Kw,电离度增大,但仍是中性水,[H+]=[OH-].
注:温度升高时Kw增大,所以说Kw时要强调温度。
练习:
|
影响因素 |
条件改变 |
平衡移动 |
溶液中的c(H+) |
溶液中的c(OH-) |
Kw |
|
温度 |
升高温度 |
向右 |
增大 |
增大 |
变大 |
|
降低温度 |
向左 |
减小 |
减小 |
变小 |
|
|
酸碱性 |
加入酸 |
向左 |
增大 |
减小 |
不变 |
|
加入碱 |
向左 |
减小 |
增大 |
不变 |
过渡:在常温时,由于水的电离平衡的存在,不仅是纯水,就是在酸性或碱性的稀溶液里,H+ 浓度和OH-浓度的乘积总是一个常数--1×10-14,请考虑一下,当纯水中加入盐酸或氢氧化钠时,c(H+)和c(OH-)如何变化?
板书:二、溶液的酸碱性和pH(常温下):