1盐类水解的实质_________________________________________________________
注意以下几点:1能发生水解反应的盐,必须是含有弱根离子(弱碱阳离子或弱酸根离子)的可溶性盐。如__________________________
2盐类水解过程就是水的电离平衡移动过程,也就是说,盐类的水解能促进水的电离。使水的电离度增大。即在常温下,可水解盐溶液中由水电离出的c(OH_)___10-7mol/L.(>、<、=)
3盐类水解反应生成酸和碱,所以盐类水解反应可看着是中和反应的逆反应。
2盐类水解的类型和规律
1强碱弱酸盐水解,溶液呈_____性,PH____7。如CH3COONa、______、______等。原因是_______与水电离出的___结合生成_______.从而使溶液中c(H+) ,c(OH-) ,从而使c(OH-) c(H+),溶液呈 性。
写出下列盐水解的离子方程式:
CH3COONa
K2CO3
2强酸弱碱盐水解,溶液呈_____性,PH____7。如NH4Cl、______、______等。原因是_______与水电离出的___结合生成_______.从而使溶液中c(H+) ,c(OH-) ,从而使c(OH-) c(H+),溶液呈 性。
写出下列盐水解的离子方程式:
FeCl3
NH4Cl
3强酸强碱盐不发生水解,溶液呈_____性,PH____7。
4弱酸弱碱盐强烈水解,溶液的酸碱性取决于形成盐的酸和碱的相对强弱。
5弱酸酸式盐的水解。溶液液的酸碱性取决于酸式根离子的电离程度和水解程度的相对大小。若电离程度_____水解程度,则溶液呈酸性。如NaHSO3、NaH2PO4等。若电离程度______水解程度,则溶液呈碱性。如NaHCO3Na2HPO4等
水解规律:“谁弱谁水解,无弱不水解,都弱双水解,谁强显谁性,都强显中性。”
针对性练习:
(1)用_______可鉴别NH4Cl、NaCl、CH3COONa三种溶液。
(2)相同浓度的Na2CO3、NaHCO3、CH3COONa溶液的PH大小顺序为___________________
(3)相同浓度拓NaX、NaY、NaZ溶液的PH值分别等于8、9、10,则对应三种酸的酸性强弱顺序为________________________.
3影响盐类水解的因素
1盐类本身原性质:这是影响盐类水解的主要因素。组成盐的酸或碱越弱,其水解程度越大,溶液的碱性或酸性越强。
2温度:盐的水解是_____热反应。因此升高温度其水解程度_____.
3浓度:盐的浓度越小,其水解程度越______.
4溶液原酸碱性:控制溶液的酸碱性,可以促进或抑制盐的水解。如Na2CO3溶液中加碱可以_____水解。加酸可以_____水解。
针对性练习:(1)水解反应:Fe3++3H2O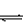 Fe(OH)3+3H+
Fe(OH)3+3H+
|
条件 |
平衡移动方向 |
Fe3+的水解程度 |
PH |
|
|
浓度 |
加FeCl3 |
|
|
|
|
加水 |
|
|
|
|
|
温度升高 |
|
|
|
|
|
加HCl |
|
|
|
|
|
加少量的NaOH |
|
|
|
|
|
加Na2CO3 |
|
|
|
(2)为什么热的纯碱溶液去污效果好?
(3)能使Na2CO3溶液中Na+与CO32- 更接近2:1的措施是
A 加水 B 加Na2CO3粉末 C 加KOH固体 D 加热
 )
)