5、 元素周期表 短周期 1、2、3
元素周期表 短周期 1、2、3
 周期 长周期4、5、6
周期 长周期4、5、6
(1)结构 不完全周期7
 主族 ⅠA-ⅦA
主族 ⅠA-ⅦA
族 副族ⅠB-ⅦB
第Ⅷ族 8、9、10 0族 惰性气体
(2)周期序数 = 电子层数 主族序数 = 原子最外层电子数
(3)每一周期从左向右,原子半径逐渐 减小;主要化合价从 +1- +7(F、O无正价),金属性逐渐减弱,非金属性逐渐增强。
每一主族从上到下右,原子半径逐渐增大 ;金属性逐渐增强 ,非金属性逐渐减弱。
|
(1)离子键:使带相反电荷的阴、阳离子结合的相互作用
离子化合物:阴、阳离子通过静电作用相成的化合物
离子键:活泼的金属 活泼的非金属
(2) 共价键:原子之间通过共用电子对所形成的强烈的相互作用
共价化合物:通过共用电子对所形成的化合物
非极性键:相同的非金属元素之间 极性键 不同的非金属元素之间
4、硝酸的制备与性质 ★NH4+ 检验:加入NaOH加热产生的气体能使湿润的红色石蕊试纸变蓝
工业制取:(1)氨在催化剂的作用下与氧气发生反应,生成NO
4NH3 + 5O2 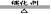 4 NO+6 H2O
4 NO+6 H2O
(2)NO与氧气反应生成NO2 2NO+O2=== 2NO2
(3)用水吸收NO2生成硝酸 3NO2 + H2O = 2HNO3+NO
性质:Cu + 4HNO3(浓)=== Cu(NO3)2+2NO2↑+2H2O 3Cu + 8HNO3(稀)==Cu(NO3)2+2NO↑+4H2O
C+ 4HNO3(浓)=== CO2↑+2NO2↑+2H2O

 常温下,浓硫酸使铁铝钝化
常温下,浓硫酸使铁铝钝化
|
|
|
|
|

|



 化学2
化学2
专题一微观结构与物质的多样性
第一单元核外电子排布
 Cl2
Cl2 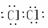 N2
N2 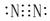 HCl
HCl 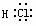 H2O
H2O CO2
CO2 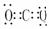 NH3
NH3 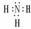 CH4
CH4 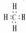 NaCl
NaCl 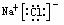 MgCl2
MgCl2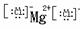 NaOH Na+
NaOH Na+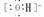
 非金属性逐渐增强
非金属性:Cl>S>P>Si,
非金属性逐渐增强
非金属性:Cl>S>P>Si, NH3↑+HCl↑ NH4HCO3
NH3↑+HCl↑ NH4HCO3 NH3·H2O
NH3·H2O