摘要: 计算反应热的规范书写: (1)设未知量.写方程式.列比例式.求解.答. (2)必须代数据.且数据后必须带单位. (3)热化学方程式必须标明每种物质的聚集状态. (4)注意正负号:放热反应的△H必然为负.但题目要求放出的热量时.放出的热量必须为正! (5)△H为对应于某一特定反应的反应热.而不是某种物质的反应热.因此不能在△H后用下标或加括号代表某种物质的反应热! (6)不能出现“3molC2H2的燃烧热 类似的表述! (7)热化学方程式的加减用数字代表即可.不需要写出中间方程式. [典例精析]
网址:http://m.1010jiajiao.com/timu_id_4021388[举报]
已知E(C-H)=414.4 Kj/mol;E(C![]() C)=615.3 kJ/mol;E(C-C)=347.4kJ/mol;E(H-H)=435.3kJ/mol.
C)=615.3 kJ/mol;E(C-C)=347.4kJ/mol;E(H-H)=435.3kJ/mol.
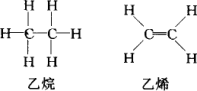
且已知乙烷(C2H6)可以裂解为乙烯和氢气,请根据化学反应中化学键的改变和键能的变化来推断该反应是放热反应还是吸热反应,并计算反应热的数值.乙烷和乙烯的结构如下:
已知E(C-H)=414.4 kJ·mol-1;E(C![]() C)=615.3 kJ·mol-1;E(C-C)=347.4 kJ·mol-1;E(H-H)=435.3 kJ·mol-1
C)=615.3 kJ·mol-1;E(C-C)=347.4 kJ·mol-1;E(H-H)=435.3 kJ·mol-1
且已知乙烷(C2H6)可以裂解为乙烯和氢气,请根据化学反应中化学键的改变和键能的变化来推断该反应是放热反应还是吸热反应,并计算反应热的数值.乙烷和乙烯的结构如下:
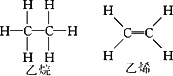
已知E(C-H)=414.4 kJ/mol;E(C![]() C)=615.3 kJ/mol;E(C-C)=347.4 kJ/mol;E(H-H)=435.3 kJ/mol,且已知乙烷(C2H6)可以裂解为乙烯和氢气,请根据化学反应中化学键的改变和键能的变化来推断该反应是放热反应还是吸热反应,并计算反应热的数值.
C)=615.3 kJ/mol;E(C-C)=347.4 kJ/mol;E(H-H)=435.3 kJ/mol,且已知乙烷(C2H6)可以裂解为乙烯和氢气,请根据化学反应中化学键的改变和键能的变化来推断该反应是放热反应还是吸热反应,并计算反应热的数值.
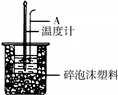 50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在图所示的装置 中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.
50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在图所示的装置 中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.(1)烧杯间填满泡沫塑料的作用是
减少实验过程中的热量损失;
减少实验过程中的热量损失;
;(2)大烧杯上若不盖硬纸板,求得的中和热数值
偏小
偏小
(填“偏大”、“偏小”、“无影响”)(3)如下图所示,仪器A的名称是
环形玻璃棒
环形玻璃棒
;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H>
>
-57.3KJ/mol(填“>”、“<”或“=”);(4)实验中改用80mL 0.50mol/L盐酸跟100mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量
不相等
不相等
(填“相等、“不相等”),所求中和热
相等
相等
(填“相等、“不相等”).(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会
偏小
偏小
;(均填“偏大”、“偏小”、“无影响”)(6)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |