题目内容
已知E(C-H)=414.4 kJ·mol-1;E(C![]() C)=615.3 kJ·mol-1;E(C-C)=347.4 kJ·mol-1;E(H-H)=435.3 kJ·mol-1
C)=615.3 kJ·mol-1;E(C-C)=347.4 kJ·mol-1;E(H-H)=435.3 kJ·mol-1
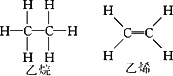
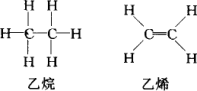
且已知乙烷(C2H6)可以裂解为乙烯和氢气,请根据化学反应中化学键的改变和键能的变化来推断该反应是放热反应还是吸热反应,并计算反应热的数值.乙烷和乙烯的结构如下:
答案:
解析:
解析:
|
答案:反应是吸热的,每反应掉1 mol乙烷,吸收的热量为125.6 kJ 解析:从键能数据估算反应热的具体方法和步骤如下: (1)写出反应的化学方程式,并突出反应物和生成物分子中的各个化学键.
(2)归纳出化学键改变的情况.6C-H+C (3)查出有关键能的数据. (4)根据下列公式粗略地估计反应热(ΔH). ΔH=∑E(反应物)-∑E(生成物) ΔH=[2E(C-H)+E(C-C)]-[E(C =(2×414.4+347.4)kJ·mol-1-(615.3+435.3)kJ·mol-1 =125.6 kJ·mol-1 这表明,上述反应是吸热的,吸收的热量为125.6 kJ·mol-1. |

练习册系列答案
相关题目

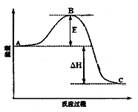
 2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题: