网址:http://m.1010jiajiao.com/timu_id_4004578[举报]

(1)制取金属镁时,可以用电解MgCl2的方法,写出相应的反应的化学方程式
| ||
| ||
(2)电解无水氯化镁产物之一的Cl2可与氧气、甲烷起反应(产物为HCl、CO),再制得盐酸使用,写出该反应的化学方程式并标出电子转移的方向和数目.
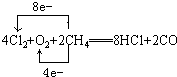
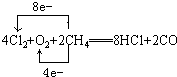
(3)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:
过滤时:
蒸发时:
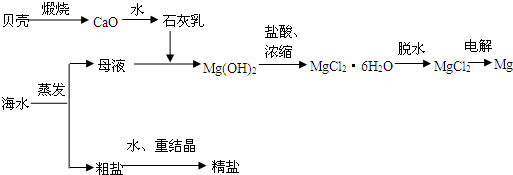
(1)贝壳的主要成份是碳酸钙,请写出由贝壳制取氧化钙的化学方程式(注明反应条件):
(2)海水提取食盐后的母液中含有K+、Na+、Mg2+等阳离子,写出加入石灰乳后生成Mg(OH)2沉淀的离子方程式:
(3)写出用电解熔融的氯化镁制镁的化学方程式
A.H2B.CO2C.O2 D.空气. 查看习题详情和答案>>
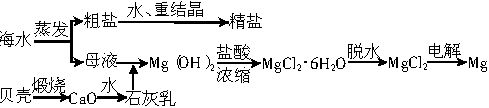
(1)粗盐中含有Ca2+、Mg2+、
 等杂质,精制后可得到NaCl饱和溶液,精制时通常在溶液中依次加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,最后加入盐酸至溶液呈中性。请写出各步可能发生的反应的离子方程式:___________
等杂质,精制后可得到NaCl饱和溶液,精制时通常在溶液中依次加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,最后加入盐酸至溶液呈中性。请写出各步可能发生的反应的离子方程式:_____________________________。
(2)从海水中提取食盐后的母液中含有K+、Na+、Mg2+等阳离子。从离子反应的角度思考,在母液里加入石灰乳起什么作用?____________________。
(3)若在空气中加热MgCl2?6H2O,生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程式:_______________________。
(4)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤:__________________。
(5)在实验室将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:____________;过滤时:___________;蒸发时:_____________。 查看习题详情和答案>>

(1)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程式。
___________________________________________________________________。
(2)Mg(OH)2沉淀中混有Ca(OH)2,应怎样除去?写出实验步骤。
___________________________________________________________________。
(3)实验室里将粗盐制取精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:___________________________________________________________;
过滤时:___________________________________________________________;
蒸发时:___________________________________________________________。
查看习题详情和答案>>
(1)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程式:______________________。
用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是______________________。
(2)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。
____________________________________________________________________。
(3)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:__________________________________________;
过滤时:__________________________________________;
蒸发时:__________________________________________。
查看习题详情和答案>>