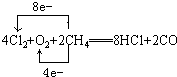题目内容
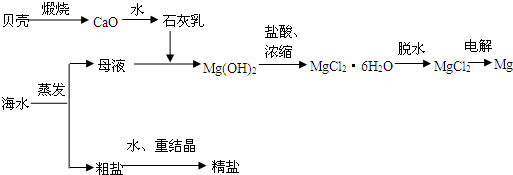
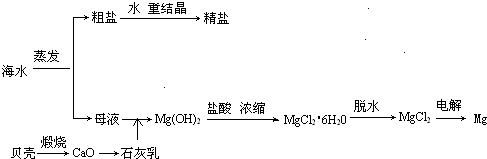
海水的综合利用可以制备金属镁,其流程如下图所示:
(1)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程式:______________________。
用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是______________________。
(2)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。
____________________________________________________________________。
(3)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:__________________________________________;
过滤时:__________________________________________;
蒸发时:__________________________________________。
解析:(1)根据Cl、H、O三种元素守恒可知,在空气中加热MgCl2·6H2O除生成Mg(OH)Cl或MgO外,还必有HCl和H2O生成。MgCl2·6H2O![]() Mg(OH)Cl+HCl↑+5H2O↑;Mg(OH)Cl
Mg(OH)Cl+HCl↑+5H2O↑;Mg(OH)Cl ![]() MgO+HCl或MgCl2·6H2O
MgO+HCl或MgCl2·6H2O![]() MgO+2HCl+5H2O;由上述反应可知MgCl2在受热时易水解,故为抑制其水解,且除去在加热过程中的水蒸气,可使MgCl2·6H2O在干燥的HCl气流中受热。(2)由于Mg(OH)2难溶于水,Ca(OH)2微溶于水,故要除去Mg(OH)2中的Ca(OH)2,需加入试剂使其将Ca(OH)2转化为易溶于水的物质,经搅拌、过滤、洗涤便可达到目的,这种可使其转化的物质一般选用MgCl2溶液或Mg(NO3)2溶液。(3)在溶解固体或稀释液体的过程中,为加速其溶解,常用玻璃棒搅拌;在过滤时,为防止液体外洒,常用玻璃棒“引流”;而在蒸发结晶的过程中,为防止局部过热或晶体飞溅,常用玻璃棒搅拌,而使其受热均匀。
MgO+2HCl+5H2O;由上述反应可知MgCl2在受热时易水解,故为抑制其水解,且除去在加热过程中的水蒸气,可使MgCl2·6H2O在干燥的HCl气流中受热。(2)由于Mg(OH)2难溶于水,Ca(OH)2微溶于水,故要除去Mg(OH)2中的Ca(OH)2,需加入试剂使其将Ca(OH)2转化为易溶于水的物质,经搅拌、过滤、洗涤便可达到目的,这种可使其转化的物质一般选用MgCl2溶液或Mg(NO3)2溶液。(3)在溶解固体或稀释液体的过程中,为加速其溶解,常用玻璃棒搅拌;在过滤时,为防止液体外洒,常用玻璃棒“引流”;而在蒸发结晶的过程中,为防止局部过热或晶体飞溅,常用玻璃棒搅拌,而使其受热均匀。
答案:(1)MgCl2·6H2O![]() Mg(OH)Cl+HCl↑+5H2O↑,Mg(OH)Cl
Mg(OH)Cl+HCl↑+5H2O↑,Mg(OH)Cl![]() MgO+HCl↑或MgCl2·6H2O
MgO+HCl↑或MgCl2·6H2O![]() MgO+2HCl↑+5H2O↑ 在干燥的HCl气流中,抑制了MgCl2的水解,且带走MgCl2·6H2O受热产生的水蒸气,故能得到无水MgCl2
MgO+2HCl↑+5H2O↑ 在干燥的HCl气流中,抑制了MgCl2的水解,且带走MgCl2·6H2O受热产生的水蒸气,故能得到无水MgCl2
(2)加入MgCl2溶液,充分搅拌、过滤,沉淀用水洗涤
(3)搅拌,加速溶解 使待滤液体沿玻璃棒流入漏斗,防止外洒 搅拌,防止因局部过热造成液滴或晶体飞溅