摘要:元素周期律和元素周期表是学习化学的一种重要工具.对整个中学化学的教学有着重大的指导作用.因此有关本部分的知识是高考必考的内容之一.热点内容主要集中在以下几个方面:一是元素周期律的迁移应用.该类题目的特点是:给出一种不常见的主族元素.分析推测该元素及其化合物可能或不可能具有的性质.解该类题目的方法思路是:先确定该元素所在主族位置.然后根据该族元素性质递变规律进行推测判断.二是确定“指定的几种元素形成的化合物 的形式.该类题目的特点是:给出几种元素的原子结构或性质特征.判断它们形成的化合物的形式.解此类题的方法思路是:定元素.推价态.想可能.得化学式.三是由“位构性 关系推断元素.该类题目综合性强.难度较大.一般出现在第Ⅱ卷笔答题中.所占分值较高. 元素周期律与元素周期表知识内容丰富.规律性强.因此命题的空间极为广阔.考查元素周期表的结构与元素性质的递变规律的试题.或以一组元素加以比较或以一种元素进行多方面的分析.具有一定的综合性.同时体现元素周期表的发现方法--分类方法的运用的试题.是高考试题中的精彩之笔,而在上海高考题中往往每年有一道与原子结构.元素周期表.元素性质相结合的推断题.这是上海试题中的一大特点.展望今后的题型会稳中有变.仍以元素及其化合物知识为载体.用物质结构理论.将解释现象.定性推断.归纳总结.定量计算相结合.向多方位.多角度.多层次方向发展. [例题]在探索生命奥秘的过程中.科学家们日益认识到生命细胞的组成和元素周期律有着密切的关系.约占人体总质量99.97%的11种宏量元素.全部位于周期表前20号元素之内.其余0.03%是由10多种人体不可缺少的微量元素组成.在微量元素中.只有F和Si位于短周期.其余均属第一长周期.在宏量元素中.除H.N.P外.在现用周期表的其余元素中: (1)原子最外层电子数是最内层电子数2倍的是 . (2)能显示化合价最多的元素是 .跟它处在同一周期的还有一种非金属元素是 . (3)原子半径最大的是 .它的相邻元素是 . (4)剩余的两种元素.它们的离子电子层结构相同.且带电量也相同.但符号相反.这两种元素是 和 . (5)氨基酸的主要组成元素为 . 解析:题干给出了与生命科学相关的大量信息.需结合生物学知识和元素周期表知识正确解题. 答案:K.Na.Ca C.H.O.N
网址:http://m.1010jiajiao.com/timu_id_3966068[举报]
元素周期表是学习化学的重要工具,它隐含许多信息和规律.
(1)以下为元素周期表的一部分,写出表中c、d的元素符号:c

(2)用元素符号标出硫在周期表中对应的位置.
(3)相同大小的a、b两种元素的单质分别投入热坩埚中,反应较剧烈的是
(4)写出c的氧化物与硫酸反应的离子方程式:
b元素的单质与e的氢化物(分子中含三个原子核)反应的化学方程式为
查看习题详情和答案>>
(1)以下为元素周期表的一部分,写出表中c、d的元素符号:c
Al
Al
dC
C

(2)用元素符号标出硫在周期表中对应的位置.
(3)相同大小的a、b两种元素的单质分别投入热坩埚中,反应较剧烈的是
K
K
(用化学式表示,下同).(4)写出c的氧化物与硫酸反应的离子方程式:
Al2O3+6H+═2Al3++3H2O
Al2O3+6H+═2Al3++3H2O
.b元素的单质与e的氢化物(分子中含三个原子核)反应的化学方程式为
2K+2H2O═2KOH+H2↑
2K+2H2O═2KOH+H2↑
.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下面是八种短周期元素的相关信息(已知铍的原子半径为0.089nm)
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色
(1)B元素在元素周期表中的位置
(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是
(3)写出B的单质和H的最高价氧化物对应水化物反应的离子方程式:
(4)H、E形成原子个数比为1:1的化合物含有的化学键类型为
(5)A、B、C、D四种元素的原子半径由小到大的顺序为(填元素符号)
查看习题详情和答案>>
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +7,-1 | -2 |
(1)B元素在元素周期表中的位置
第三周期第ⅢA族
第三周期第ⅢA族
.(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是
HClO4
HClO4
(填化学式).(3)写出B的单质和H的最高价氧化物对应水化物反应的离子方程式:
2Al+2OH-+2H2O═2AlO2-+3H2↑
2Al+2OH-+2H2O═2AlO2-+3H2↑
.(4)H、E形成原子个数比为1:1的化合物含有的化学键类型为
离子键和非极性键
离子键和非极性键
.(5)A、B、C、D四种元素的原子半径由小到大的顺序为(填元素符号)
Cl<S<Al<Mg
Cl<S<Al<Mg
.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下面是八种短周期元素的相关信息(已知铍的原子半径为0.089nm)
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色
(1)B元素在元素周期表中的位置
(2)上述五种元素的最高价氧化物对应的水化物中酸性最强的是
(3)用电子式表示A、D形成化合物的过程:
 .
.
(4)H、E形成原子个数比为1:1的化合物为
(5)F与G形成的最简单的化合物的电子式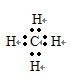
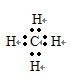 ,该分子的空间构型为
,该分子的空间构型为
(6)E的氢化物比C的氢化物的熔沸点高的原因是
(7)在有饱和食盐水的水槽中,用一倒扣在水槽中的试管用排饱和食盐水法先后收集等体积的GF4和D的单质气体,在光照条件下可观察到水槽中有晶体析出,试管内气体颜色逐渐变浅,液面上升,
查看习题详情和答案>>
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)B元素在元素周期表中的位置
第三周期第ⅢA族
第三周期第ⅢA族
.(2)上述五种元素的最高价氧化物对应的水化物中酸性最强的是
HClO4
HClO4
(填化学式).(3)用电子式表示A、D形成化合物的过程:


(4)H、E形成原子个数比为1:1的化合物为
Na2O2
Na2O2
(填化学式),含有的化学键类型为离子键和非极性键
离子键和非极性键
.(5)F与G形成的最简单的化合物的电子式
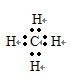
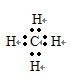
正四面体
正四面体
.(6)E的氢化物比C的氢化物的熔沸点高的原因是
水分子间存在氢键
水分子间存在氢键
.(7)在有饱和食盐水的水槽中,用一倒扣在水槽中的试管用排饱和食盐水法先后收集等体积的GF4和D的单质气体,在光照条件下可观察到水槽中有晶体析出,试管内气体颜色逐渐变浅,液面上升,
试管壁出现油状液滴
试管壁出现油状液滴
,试管中有少量白雾
试管中有少量白雾
等现象产生.元素周期表是学习化学的重要工具,它隐含许多信息和规律.
下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm).
(1)用元素代号标出它们在周期表中对应位置(以下为周期表的一部分).
(2)B元素处于周期表中 周期 族;
(3)在元素周期表中 的分界处,可以找到制半导体材料的元素;
(4)上述五种元素的最高价氧化物对应水化物酸性最强的是 (填化学式);
(5)用电子式表示A、D形成化合物的过程 ;
(6)C、E形成化合物为 (填化学式),含化学键类型为 .
查看习题详情和答案>>
下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm).
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(3)在元素周期表中
(4)上述五种元素的最高价氧化物对应水化物酸性最强的是
(5)用电子式表示A、D形成化合物的过程
(6)C、E形成化合物为
 )
)