摘要:13.实验探究:通过实验事实的验证与讨论.认识苯的结构式. 提出问题:苯分子结构是碳碳单键.双键交替的环状结构吗? (1)提出假设:从苯的分子式看.C6H6具有不饱和性,从苯的凯库勒结构式看.分子中含有碳碳双键.所以.苯一定能使 褪色. (2)实验验证: ①苯不能使 褪色. ②经科学测定.苯分子里6个碳原子之间的键 ,6个碳原子和6个氢原子都在同一 上. (3)结论:苯的凯库勒结构式中的双键跟烯烃中的双键 .苯的性质没有表现出不饱和性.反而结构稳定.说明苯分子 一般的碳碳单.双键交替的环状结构. (4)应用:为了表示苯分子的结构特点.结构简式用 表示.用凯库勒式表示苯分子的结构是不确切的. 解析:含有碳碳双键物质的化学性质类似于烯烃.能和溴水发生加成反应而使溴水褪色.能被高锰酸钾酸性溶液氧化而使高锰酸钾酸性溶液褪色.但通过实验发现苯不能使溴水褪色.也不能被高锰酸钾酸性溶液氧化.说明苯中的化学键是一种特殊的化学键.不能用单.双键交替的形式来表示.因此用凯库勒结构式表示苯分子的结构有一定的局限性. 答案:(1)KMnO4酸性溶液或溴水 (2)①KMnO4酸性溶液或溴水 ②相同 平面
网址:http://m.1010jiajiao.com/timu3_id_80889[举报]
实验探究:
通过实验事实的验证与讨论,认识苯的结构式.提出问题:苯分子结构是碳碳单双键交替的结构吗?
(1)提出假设:从苯的分子式看,C6H6具有不饱和性;从苯的凯库勒结构式看,分子中含有碳碳双键,所以,苯一定能使________褪色;
(2)实验验证:
①苯不能使________褪色;
②经科学测定,苯分子里6个碳原子之间的键________(填“相同”或“不同”);6个碳原子和6个氢原子都在同一________上;
(3)结构:苯的凯库勒结构式中的双键跟烯烃的双键________(填“相同”或“不同”);苯的性质没有表现出不饱和性,结构稳定,说明苯分子________(填“有”或“没有”)一般的碳碳单、双键交替的环状结构.
(4)应用:为了表示苯分子的结构特点,结构简式用________表示,而凯库勒式表示苯分子结构是不确切的.
某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验.
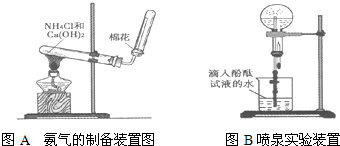
(1)根据图写出实验室制取氨气的化学方程式 ;收集氨气的方法是 .
(2)甲组同学用干燥的圆底烧瓶收集一瓶氨气,根据图B进行实验,观察到美丽的红色喷泉.根据实验现象说明氨气具有的性质是 ;喷泉结束后,计算烧瓶内溶液中NH3的物质的量浓度 .(假设该实验条件下气体摩尔体积约为25.0L/mol)
(3)乙组同学根据图B进行实验探究,通过改变烧瓶中的气体、胶头滴管和烧杯中的液体,也成功观察到喷泉.乙组同学所选的试剂可能是 .(用选项字母回答)
查看习题详情和答案>>

(1)根据图写出实验室制取氨气的化学方程式
(2)甲组同学用干燥的圆底烧瓶收集一瓶氨气,根据图B进行实验,观察到美丽的红色喷泉.根据实验现象说明氨气具有的性质是
(3)乙组同学根据图B进行实验探究,通过改变烧瓶中的气体、胶头滴管和烧杯中的液体,也成功观察到喷泉.乙组同学所选的试剂可能是
| 选项 | 气体 | 液体 |
| A | NO2 | H2O |
| B | Cl2 | 饱和食盐水 |
| C | CO2 | NaOH溶液 |
| D | CO | Na2CO3溶液 |
| E | SO2 | NaOH溶液 |
已知某种治疗胃病药品的主要成份是铝碳酸镁片,化学式为AlaMgb(OH)mCO3?n H2O,假设药品中的其它成份受热不分解,不溶于水且不与稀硫酸反应.某研究性学习小组设计了如下实验探究铝碳酸镁片的组成.
实验一:取mg该药片,研成粉末放入硬质玻璃管中,加热,充分反应后测得装置C增重2.16g,装置D增重0.44g.

(1)装置C和D中盛放的药品是:C D
(2)实验开始前先通入一段时间空气,其目的是 ,其操作方法是 .当B处的酒精灯点燃后以及反应结束后一段时间内仍然要通入空气的目的是 .
实验二:另取m g该药片,加入100mL1mol/L的稀硫酸,充分反应后滤去不溶物,向滤液中逐渐加入1mol/L的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液体积之间的关系如图:
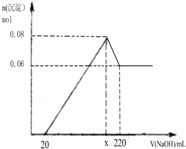
(3)根据以上所给数据求出x=
(4)通过计算确定铝碳酸镁的化学式为
(5)有医生建议患有严重胃溃疡的患者最好慎用该药,试用你所学的知识解释这样建议的理由是 .
(6)有同学认为,不需要做实验一,只需要在实验二的基础上再得知两个数据就可以求出铝碳酸镁的化学式,你认为这两个数据应该是: 、 .
查看习题详情和答案>>
实验一:取mg该药片,研成粉末放入硬质玻璃管中,加热,充分反应后测得装置C增重2.16g,装置D增重0.44g.

(1)装置C和D中盛放的药品是:C
(2)实验开始前先通入一段时间空气,其目的是
实验二:另取m g该药片,加入100mL1mol/L的稀硫酸,充分反应后滤去不溶物,向滤液中逐渐加入1mol/L的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液体积之间的关系如图:

(3)根据以上所给数据求出x=
(4)通过计算确定铝碳酸镁的化学式为
(5)有医生建议患有严重胃溃疡的患者最好慎用该药,试用你所学的知识解释这样建议的理由是
(6)有同学认为,不需要做实验一,只需要在实验二的基础上再得知两个数据就可以求出铝碳酸镁的化学式,你认为这两个数据应该是:
过氧化钠(Na2O2)是中学常见物质,常见的过氧化物还包括过氧化钙(CaO2).已知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成.有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同.据此设计如下实验操作进行判断.
实验一:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点.
(1)提出假设:
假设1:反应后固体中只有
假设2:反应后固体中只有
假设3:
实验探究:
实验二:通过测量气体的体积判断发生的化学反应,实验装置如图: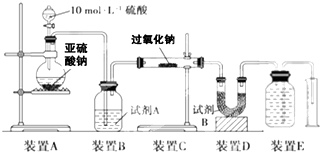
(2)试剂A可以选用
(3)实验测得装置C中过氧化钠质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),用上述有关测量数据判断,SO2未被氧化、完全被氧化的V-m1关系式.
未被氧化:
(4)若SO2完全被氧化,写出反应的化学方程式:
查看习题详情和答案>>
实验一:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点.
(1)提出假设:
假设1:反应后固体中只有
Na2SO3
Na2SO3
,证明SO2未被氧化;假设2:反应后固体中只有
Na2SO4
Na2SO4
,证明SO2完全被氧化;假设3:
Na2SO3和Na2SO4的混合物
Na2SO3和Na2SO4的混合物
证明SO2被部分氧化
SO2被部分氧化
.实验探究:
实验二:通过测量气体的体积判断发生的化学反应,实验装置如图:

(2)试剂A可以选用
浓H2SO4
浓H2SO4
,试剂B的作用是吸收未反应的SO2
吸收未反应的SO2
.(3)实验测得装置C中过氧化钠质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),用上述有关测量数据判断,SO2未被氧化、完全被氧化的V-m1关系式.
未被氧化:
V=
L
| 7m1 |
| 30 |
V=
L
,完全被氧化:| 7m1 |
| 30 |
V=0
V=0
.(4)若SO2完全被氧化,写出反应的化学方程式:
SO2+Na2O2═Na2SO4
SO2+Na2O2═Na2SO4
.Cu-Fe合金由于长时间置于空气中表面产生了一层氧化膜(成分为Fe2O3和CuO),一化学研究性学习小组对其进行如下探究,请按要求完成下列探究报告.
[探究目的]实验测定样品中Fe,Cu的质量.
[探究思路]设计实验测量有关反应物和生成物的量,并通过计算确定样品中Fe,Cu的质量.
[实验探究](本实验中的气体体积均已换算成标准状况)
①将此合金5.76g置于烧杯中,然后将稀H2SO4逐渐缓慢加入至过量,收集产生的气体测得其体积为VmL.过滤得浅绿色溶液A(不含Cu2+),还有滤渣B.
②将滤渣B投入到一定浓度的HNO3中,完全溶解,收集产生的气体,经分析气体是NO和NO2的混合气体,总体积896mL,其中NO2体积为224mL.
③将①中所得的滤液加入到足量的稀HNO3中,充分反应后再加入足量的NaOH溶液,将产生的沉淀全部滤出,充分加热灼烧得红棕色固体,称量该固体的质量为3.2g.
[结果处理]
(1)A中存在的阳离子有
(2)依次写出步骤③中加入HNO3时发生反应的离子反应方程式
(3)被腐蚀前的合金中Fe的质量为
(4)实验探究①中V为
查看习题详情和答案>>
[探究目的]实验测定样品中Fe,Cu的质量.
[探究思路]设计实验测量有关反应物和生成物的量,并通过计算确定样品中Fe,Cu的质量.
[实验探究](本实验中的气体体积均已换算成标准状况)
①将此合金5.76g置于烧杯中,然后将稀H2SO4逐渐缓慢加入至过量,收集产生的气体测得其体积为VmL.过滤得浅绿色溶液A(不含Cu2+),还有滤渣B.
②将滤渣B投入到一定浓度的HNO3中,完全溶解,收集产生的气体,经分析气体是NO和NO2的混合气体,总体积896mL,其中NO2体积为224mL.
③将①中所得的滤液加入到足量的稀HNO3中,充分反应后再加入足量的NaOH溶液,将产生的沉淀全部滤出,充分加热灼烧得红棕色固体,称量该固体的质量为3.2g.
[结果处理]
(1)A中存在的阳离子有
Fe2+,H+
Fe2+,H+
,滤渣B为Cu
Cu
.(2)依次写出步骤③中加入HNO3时发生反应的离子反应方程式
3Fe2++4H++NO3-═3Fe3++NO↑+2H2O
3Fe2++4H++NO3-═3Fe3++NO↑+2H2O
.(3)被腐蚀前的合金中Fe的质量为
2.24
2.24
g,Cu的质量为3.2
3.2
g.(4)实验探究①中V为
448
448
mL.