题目内容
某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验.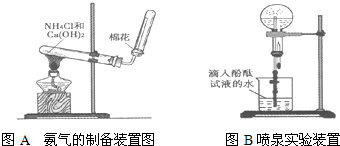
(1)根据图写出实验室制取氨气的化学方程式
(2)甲组同学用干燥的圆底烧瓶收集一瓶氨气,根据图B进行实验,观察到美丽的红色喷泉.根据实验现象说明氨气具有的性质是
(3)乙组同学根据图B进行实验探究,通过改变烧瓶中的气体、胶头滴管和烧杯中的液体,也成功观察到喷泉.乙组同学所选的试剂可能是
| 选项 | 气体 | 液体 |
| A | NO2 | H2O |
| B | Cl2 | 饱和食盐水 |
| C | CO2 | NaOH溶液 |
| D | CO | Na2CO3溶液 |
| E | SO2 | NaOH溶液 |
分析:(1)实验室用加热氯化铵和氢氧化钙混合物的方法制取氨气;易溶于水且密度小于空气的气体采用向下排空气法收集;
(2)极易溶于该溶液的气体能形成喷泉,氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子和铵根离子而使溶液呈碱性;
溶液的物质的量浓度=
=
=
;
(3)只要这种气体极易溶于该溶液,能形成压强差就能形成喷泉实验.
(2)极易溶于该溶液的气体能形成喷泉,氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子和铵根离子而使溶液呈碱性;
溶液的物质的量浓度=
| n(氨气) |
| V(溶液) |
| ||
| V |
| 1 |
| Vm |
(3)只要这种气体极易溶于该溶液,能形成压强差就能形成喷泉实验.
解答:解:(1)在加热条件下,氯化铵和氢氧化钙反应生成氯化钙、氨气和水,反应方程式为:2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑,氨气极易溶于水,所以不能采用排水法收集,氨气的密度小于空气且不和空气反应,所以采用向下排空气法收集,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑;向下排空气法;
(2)氨气极易溶于水而形成较大的压强差,从而形成喷泉,氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子和铵根离子而使溶液呈碱性,无色酚酞试液遇碱变红色,所以该实验说明氨气极易溶于水且氨水呈碱性;
溶液的物质的量浓度=
=
=
=
mol.L=0.04mol/L,
故答案为:氨气极易溶于水且氨水呈碱性;
(3)只要这种气体极易溶于该溶液,能形成压强差就能形成喷泉实验,
A.二氧化氮和水反应生成硝酸和一氧化氮,且反应剧烈,所以能形成喷泉,故A正确;
B.氯化钠中含有氯离子,抑制氯气溶解,所以不能形成喷泉,故B错误;
C.二氧化碳极易溶于氢氧化钠溶液,所以能形成喷泉,故C正确;
D.一氧化碳和碳酸钠溶液不反应,所以不能形成喷泉,故D错误;
E.二氧化硫极易溶于氢氧化钠溶液,所以能形成喷泉,故D正确;
故选ACE.
| ||
| ||
(2)氨气极易溶于水而形成较大的压强差,从而形成喷泉,氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子和铵根离子而使溶液呈碱性,无色酚酞试液遇碱变红色,所以该实验说明氨气极易溶于水且氨水呈碱性;
溶液的物质的量浓度=
| n(氨气) |
| V(溶液) |
| ||
| V |
| 1 |
| Vm |
| 1 |
| 25.0 |
故答案为:氨气极易溶于水且氨水呈碱性;
(3)只要这种气体极易溶于该溶液,能形成压强差就能形成喷泉实验,
A.二氧化氮和水反应生成硝酸和一氧化氮,且反应剧烈,所以能形成喷泉,故A正确;
B.氯化钠中含有氯离子,抑制氯气溶解,所以不能形成喷泉,故B错误;
C.二氧化碳极易溶于氢氧化钠溶液,所以能形成喷泉,故C正确;
D.一氧化碳和碳酸钠溶液不反应,所以不能形成喷泉,故D错误;
E.二氧化硫极易溶于氢氧化钠溶液,所以能形成喷泉,故D正确;
故选ACE.
点评:本题考查了实验室制取氨气、氨气的收集、喷泉实验的条件等知识点,明确实验原理是解本题关键,根据气体的溶解性及密度确定收集方法,根据喷泉实验的形成条件确定是否能形成喷泉,注意:并不是只有氯化氢、氨气和水能形成喷泉,只要这种气体极易溶于该溶液就能形成喷泉,为易错点.

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
某研究性学习小组为了探索镁粉与FeCl3溶液的反应机理,做了如下两组实验:
①将镁粉投入冷水中,未见明显现象;
②将镁粉投入FeCl3溶液中,观察到有气泡产生,溶液颜色逐渐变浅,同时逐渐产生红褐色沉淀.
则下列有关镁与FeCl3溶液反应的叙述中,正确的是( )
①将镁粉投入冷水中,未见明显现象;
②将镁粉投入FeCl3溶液中,观察到有气泡产生,溶液颜色逐渐变浅,同时逐渐产生红褐色沉淀.
则下列有关镁与FeCl3溶液反应的叙述中,正确的是( )
| A、镁只与FeCl3溶液中的Fe3+直接反应 | B、气泡是镁与FeCl3溶液中的水直接反应产生的 | C、红褐色沉淀是镁与水反应生成的Mg(OH)2与Fe3+反应所得 | D、汽泡是镁与FeCl3水解生成的盐酸反应产生的 |
 Cu(OH)2+2H+
Cu(OH)2+2H+ “白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
“白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案: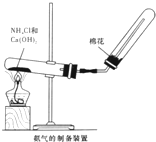 某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验.
某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验.