摘要:下表是元素周期表的前三周期.用相应的化学用语回答下列问题: a b c d e f g (1)g的单质与f元素的最高价氧化物的水化物反应的离子方程式为 . (2)第三周期8种元素按单质熔点(℃)大小顺序的柱形图(上左图).其中横座标:“2 代表 .“8 代表 . (3)a.b.c.d.e的氢化物的沸点直角坐标图(上右图).横座标序号“1 氢化物的体类别为 :①共价化合物.②离子化合物, CH4位于该坐标图中的横座标的序号 ,某燃料电池用CH4作燃料.KOH溶液作电解质.则该燃料电池负极的电极反应为: .
网址:http://m.1010jiajiao.com/timu3_id_49293[举报]
下表是元素周期表的前三周期,回答下列问题:

(1)f、g元素的单质共5.0g在100mL水中完全反应,生成的溶液中只含有一种溶质,分步写出发生反应的化学方程式:①
(2)a、b、c、d、e的氢化物的沸点直角坐标图如图所示,序号“5”氢化物的化学式为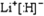
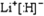 .
.
查看习题详情和答案>>

(1)f、g元素的单质共5.0g在100mL水中完全反应,生成的溶液中只含有一种溶质,分步写出发生反应的化学方程式:①
2Na+2H2O=2NaOH+H2↑
2Na+2H2O=2NaOH+H2↑
②2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
.所得溶液的物质的量浓度最大值为1mol/L
1mol/L
.(液体的体积变化忽略不计)(2)a、b、c、d、e的氢化物的沸点直角坐标图如图所示,序号“5”氢化物的化学式为
CH4
CH4
,序号“1”氢化物的电子式为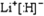
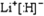

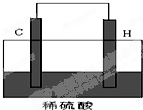
 下表是元素周期表的前三周期:
下表是元素周期表的前三周期:| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 一 | A | |||||||
| 二 | B | C | D | E | F | |||
| 三 | G | H | I | J |
(1)写出下列元素的元素的符号:F
F
F
、JAr
Ar
.(2)G元素与E元素形成的化合物的化学式是
Na2O
Na2O
、Na2O2
Na2O2
,它们都是离子
离子
(填“离子”或“共价”)化合物.(3)表格中十种元素的最高氧化物对应的水化物中,酸性最强的是
HClO4
HClO4
,属于两性氢氧化物的是Al(OH)3
Al(OH)3
(用化合物的化学式表示).(4)只含有A、C两种元素的化合物称为
烃
烃
,这些化合物中:①相对分子质量最小的是
CH4
CH4
,该化合物的分子空间构型是正四面体
正四面体
;②分子中含有双键,但原子数最少的是
CH2=CH2
CH2=CH2
,它与HCl反应的化学方程式为CH2=CH2+HCl→CH3CH2Cl
CH2=CH2+HCl→CH3CH2Cl
;(5)将H单质与C的一种单质(导体)按如图装置连接,该装置称为
原电池
原电池
.其中C极为正极
正极
,(填正负极)并写出该电极反应式为:2H++2e-=H2↑
2H++2e-=H2↑
.电子流动方向H流向C
H流向C
. 下表是元素周期表的前三周期:
下表是元素周期表的前三周期:| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 一 | A | |||||||
| 二 | B | C | D | E | F | |||
| 三 | G | H | I | J | K |
(1)写出下列元素的元素符号:D
N
N
、KAr
Ar
.(2)G元素与F元素形成的化合物的化学式是
NaF
NaF
、它是离子
离子
(填“离子”或“共价”)化合物.(3)非金属性最强的元素是
F
F
,I和J最高价氧化物对应水化物的酸性强弱关系是H2SO4
H2SO4
<HClO4
HClO4
.(填化学式)(4)写出化合物A2E2的电子式
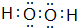
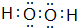
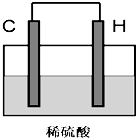
(5)将H单质与C的一种单质(导体)按如图装置连接,对该装置判断正确的是
C
C
A.C极是原电池的负极,发生还原反应
B.C极是原电池的正极,发生氧化反应
C.H极是原电池的负极,发生氧化反应
D.H极是原电池的正极,发生还原反应
(6)下列判断正确的是
B
B
A、原子半径:B<C<D<E<F B、氢化物稳定性:C<D
C、G能从H的盐溶液中置换出H D、简单阴离子的还原性:I<J.
下表是元素周期表的前三周期主族和0族元素区,表中虚线处为ⅡA、ⅢA族的连接处,请用相应的化学用语回答下列问题:

(1)写由仅由e形成的两种带有相同电荷数的阴离子的符号
(2)d元素名称为
 .
.

(3)图Ⅰ是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表的是(填化学式)
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(图Ⅱ)中序列“5”的氢化物的名称是
查看习题详情和答案>>

(1)写由仅由e形成的两种带有相同电荷数的阴离子的符号
O2-
O2-
、O22-
O22-
.(2)d元素名称为
氮
氮
,其双原子分子的电子式为


(3)图Ⅰ是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表的是(填化学式)
Si
Si
晶体,1mol该晶体中含有2
2
mol化学键.(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(图Ⅱ)中序列“5”的氢化物的名称是
甲烷
甲烷
,空间构型为正四面体
正四面体
;序列“2”的氢化物的结构式是H-O-H
H-O-H
,属于极性
极性
(填“极性”或“非极性”)分子.(16分)下表是元素周期表的前三周期:
| | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | A | | | | | | | |
| 二 | B | | | C | D | E | F | |
| 三 | G | | H | | | | I | J |
⑴写出下列元素的元素的符号:
F______________、J_____________。
⑵G元素与E元素形成的化合物的化学式是____________、____________,它们都是_________________(填“离子”或“共价”)化合物。
⑶表格中十种元素的最高氧化物对应的水化物中,酸性最强的是_____________,属于两性氢氧化物的是_______________(用化合物的化学式表示)。
⑷只含有A、C两种元素的化合物称为_____________,这些化合物中:
①相对分子质量最小的是________________,该化合物的分子空间构型是_______________;
②分子中含有双键,但原子数最少的是______________,它与HCl反应的化学方程式为______________________________;
⑸将H单质与C的一种单质(导体)按如下图装置连接,该装置称为_____________。其中C极为______________,(填正负极)并写出该电极反应式为:____________________。请在下图中标出电子流动方向。
 查看习题详情和答案>>
查看习题详情和答案>>